
| NaCN |
| HCl |
| 水解 |
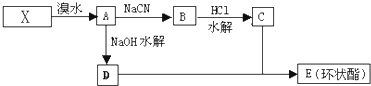
 ,据此解答.
,据此解答. ,
,| 浓硫酸 |
| △ |
 +2H2O,
+2H2O,| 浓硫酸 |
| △ |
 +2H2O;
+2H2O;| △ |
| △ |


科目:高中化学 来源: 题型:
| A、高温、高压 |
| B、高温、低压 |
| C、低温、低压 |
| D、适当温度、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| B、硫代硫酸钠溶液和稀硫酸反应:SO42--+S2O32-+6H+=3SO2↑+3H2O |
| C、碳酸氢钠溶液与足量的氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、酸性高锰酸钾与草酸反应:MnO4-+H2C2O4+2H+=MnO2+2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
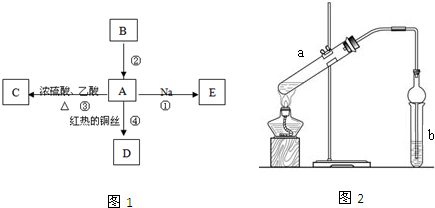
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取a克混合物充分加热,减重b克 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| C、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
| D、取a 克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得 b 克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
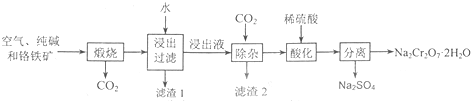
| ||
. |
| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中,c为阳极,d为阴极 |
| B、装置②可用于收集H2、NH3、Cl2、HCl、NO2等 |
| C、装置③中X为苯,可用于吸收氨气或氯化氢 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com