
分析 n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,
①根据Na原子守恒计算生成的NaOH的物质的量;
②根据转移电子守恒计算生成的H2的体积(标准状况);
③如反应后得到的溶液中Na+与水分子的个数比为1:100,根据N=nNA知,则钠离子和溶液中水分子的物质的量之比为1:100,Na和水反应还消耗水,根据方程式知,消耗水的物质的量等于钠的物质的量,据此计算开始时所用的水的质量.
解答 解:n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,
①根据Na原子守恒得生成n(NaOH)=n(Na)=0.1mol,答:生成NaOH的物质的量是0.1mol;
②该反应中钠失去电子的物质的量等于生成氢气得到电子的物质的量,根据转移电子守恒得V(H2)=$\frac{0.1mol×1}{2}×22.4L/mol$=1.12L,
答:生成氢气的体积为1.12L;
③如反应后得到的溶液中Na+与水分子的个数比为1:100,根据N=nNA知,则钠离子和溶液中水分子的物质的量之比为1:100,所以溶液中还剩余n(H2O)=100n(Na+)=100n(Na)=100×0.1mol=10mol;
Na和水反应还消耗水,根据方程式知,消耗水的物质的量等于钠的物质的量,所以消耗n(H2O)=n(Na)=0.1mol,则开始时所用n(H2O)=(10+0.1)mol=10.1mol,其质量=10.1mol×18g/mol=181.8g,
答:开始时所用的水的质量是181.8g.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量的关系式是解本题关键,注意原子守恒、转移电子守恒的灵活运用,侧重考查学生分析计算能力,注意③中易漏掉参加反应的水的质量,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:实验题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为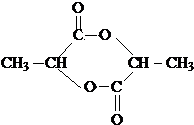 ,聚乳酸的结构简式为
,聚乳酸的结构简式为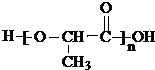 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
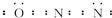 ,其分子空间构型是直线形.
,其分子空间构型是直线形.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com