
 莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中,下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中,下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸能消耗等量的NaOH |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 键长越长,键能越小,共价化合物越稳定 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 键角是确定多分子立体结构(分子形状)的重要参数 | |
| D. | 同种原子间形成的共价键键长长短总是遵循:叁键<双键<单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 30% | C. | 50% | D. | 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
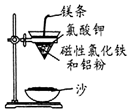 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| B. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 反应起始时和达平衡时的压强比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有8个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com