
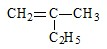
 的名称
的名称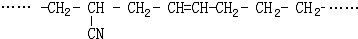 则合成它的单体是
则合成它的单体是 羟基电子式为
羟基电子式为 ,故答案为:
,故答案为: ;
; ;
;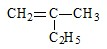 的键线式为:
的键线式为: ;CH3CH2CH2COOH的键线式为:
;CH3CH2CH2COOH的键线式为: ,故答案为:
,故答案为: ;
; ;
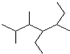
; 的结构简式为CH3CHCH3CHCH3CH(C2H5)CHCH3CH2CH3,主链有7个碳原子,从左端开始编号,2,3,5号碳原子上各有1个甲基,4号碳原子上有1个乙基,其名称为:2,3,5-三甲基-4-乙基庚烷,故答案为:2,3,5-三甲基-4-乙基庚烷;
的结构简式为CH3CHCH3CHCH3CH(C2H5)CHCH3CH2CH3,主链有7个碳原子,从左端开始编号,2,3,5号碳原子上各有1个甲基,4号碳原子上有1个乙基,其名称为:2,3,5-三甲基-4-乙基庚烷,故答案为:2,3,5-三甲基-4-乙基庚烷;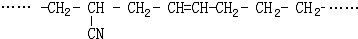 是由CH2=CH-CN、CH2=CH-CH=CH2、CH2=CH2三种单体加聚而成,所以其单体为:CH2=CH-CN、CH2=CH-CH=CH2、CH2=CH2;
是由CH2=CH-CN、CH2=CH-CH=CH2、CH2=CH2三种单体加聚而成,所以其单体为:CH2=CH-CN、CH2=CH-CH=CH2、CH2=CH2;

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 判断依据 | 结论(写结构简式) |
| 核磁共振氢谱有 个峰 | |
| 核磁共振氢谱有 个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
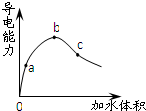 常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a和d是同分异构体,且都可以发生取代反应 |
| B、b和c是同系物,且都只有一种一氯代物 |
| C、a和d都能发生加成反应,且在空气中燃烧都有黑烟 |
| D、c和d是同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com