
分析 (1)二氧化氮和水能反应,一氧化氮和水不反应,根据差量法计算二氧化氮的体积,从而得出一氧化氮的体积;
(2)根据一氧化氮、氧气和水反应方程式进行计算;
(3)由关系式4NO~3O2计算出24 mLNO消耗O2的体积,从而可得出剩余氧气体积;
(4)根据反应4NO+3O2+2H2O═4HNO3、4NO2+O2+2H2O═4HNO3及二氧化氮、NO的体积计算出消耗氧气的总体积.
解答 解:(1)一氧化氮和水不反应,二氧化氮和水能反应,反应方程式为:3NO2+H2O=2HNO3+NO,
设二氧化氮的体积为x,
3NO2+H2O=2HNO3+NO 气体体积减少
3 2
x (48-24)mL=24mL
x=$\frac{24mL×3}{2}$=36mL,
则一氧化氮体积=(48-36)mL=12mL,
NO体积是 12mL,二氧化氮体积是NO2 36 mL,
故答案为:12;36;
(2)剩余气体是一氧化氮,一氧化氮、氧气和水之间的反应式为:4NO+3O2+2H2O=4HNO3,
根据方程式知,一氧化氮和氧气反应的关系是4:3,则有24mL一氧化氮反应时需要18mL氧气,实际上有6mL氧气,所以一氧化氮有剩余,剩余的一氧化氮体积=24mL-$\frac{6mL}{3}$×4=16mL,
故答案为:16;
(3)由4NO~3O2知,24 mLNO消耗O2的体积为:$\frac{3}{4}$×24mL=18mL,所以反应后容器内剩余O2为:24 mL-18 mL=6 mL,
故答案为:6;
(4)由4NO+3O2+2H2O═4HNO3
4 3
12mL 9mL
4NO2+O2+2H2O═4HNO3
4 1
36 mL 9 mL
则需要通入18 mL O2,可使管内气体全部被H2O吸收,
故答案为:18.
点评 本题考查了混合物反应的计算,题目难度中等,明确二氧化氮、一氧化氮的性质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合理膳食、合理用药是人体健康的需要.
合理膳食、合理用药是人体健康的需要.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
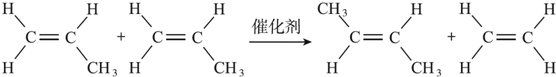
 +CH2=CH2.
+CH2=CH2.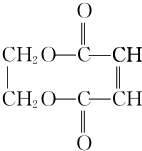 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | CH2═CH-CH═CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH2-CH3 | |
| C. |  | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
查看答案和解析>>
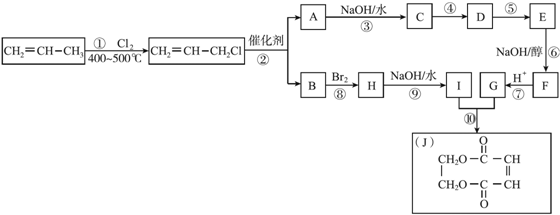
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | SO2 | H2S |
| B | CO2 | Cl2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com