
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A. 一定有氧元素参加
B. 还原剂本身被还原
C. 氧化反应一定先于还原反应发生
D. 一定有电子转移(得失或偏移)
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0)
2SO3(g)+Q (Q>0)
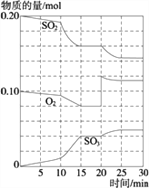
(1)写出该反应的化学平衡常数表达式K=_________.
(2)降低温度,该反应K值_________,二氧化硫转化率_________,正反应速度_________.(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_________.
据图判断,反应进行至20 min时,曲线发生变化的原因_____________________(用文字表达);10 min到15 min的曲线变化的原因可能是_________(填写编号).
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作或事故处理方法正确的是( )
A. 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿内称量
B. 实验室制取氧气时,先加入药品,然后再检查装置的气密性
C. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀碳酸氢钠溶液
D. 粗盐提纯时,将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y(g)3Z(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
A.v(正)减小,v(逆)增大
B.v(正)增大,v(逆)减小
C.v(正)、v(逆)都减小
D.v(正)、v(逆)都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
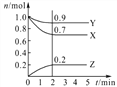
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol·L-1Q溶液是AG(酸度)=lg =-12,由M和Y组成的化合物MY是强电解质。下列说法正确的是
=-12,由M和Y组成的化合物MY是强电解质。下列说法正确的是
A. 简单离子半径:Y>R>X B. Y的氧化物对应的水化物一定是强酸
C. X分别与M、R、Y组成的二元化合物中都只含离子键 D. 化合物XRM和XYR均能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的根本原因是( )
A. 元素质量数的递增 B. 元素的原子半径呈周期性变化
C. 金属性和非金属性呈周期性变化 D. 原子核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可获成功的是( )
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯
C. 将电石和饱和食盐水置于启普发生器中制取乙炔
D. 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com