
| ||


科目:高中化学 来源: 题型:
| A、含碳元素的化合物都是有机物 |
| B、完全燃烧只生成CO2和H2O的化合物都是烃 |
| C、大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键 |
| D、有机物完全燃烧只可能生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①②③ |
| C、①②⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组同学利用右图所示装置探究氨气的性质.
某小组同学利用右图所示装置探究氨气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:
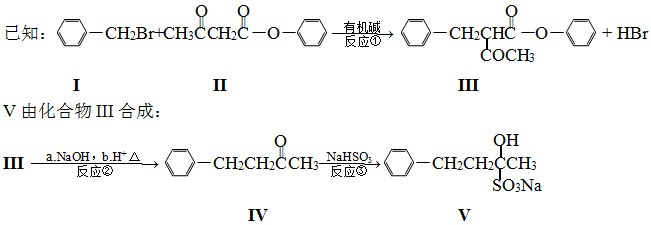
查看答案和解析>>
科目:高中化学 来源: 题型:
 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,如图砷化镓晶胞.下列说法正确的是( )
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,如图砷化镓晶胞.下列说法正确的是( )| A、砷化镓晶胞结构与NaCl相同 |
| B、第一电离能:As<Ga |
| C、电负性:As<Ga |
| D、砷和镓都属于p区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氧气 |
| B、制取二氧化碳 |
| C、粗盐提纯 |
| D、用氯化钠晶体配制100g 5%的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com