
| A. | 离子键 | B. | 金属键 | C. | 氢键 | D. | 极性共价键 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,等质量的SO2和CO2密度比为11:16 | |
| B. | 同温同压下,等质量的SO2和CO2体积比为1:1 | |
| C. | 等物质的量的氢气和氦气在同温同压下具有相等的质子数 | |
| D. | 标准状况下气体摩尔体积就是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

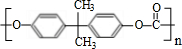 .
.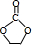 +2CH3OH$\stackrel{一定条件}{→}$CH3OCOOCH3+HOCH2CH2OH.
+2CH3OH$\stackrel{一定条件}{→}$CH3OCOOCH3+HOCH2CH2OH. (写结构简式)
(写结构简式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
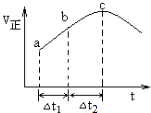
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 1:5 | C. | 6:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | 过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 | |
| C. | 结合质子能力由强到弱的顺序为:HCO3->CN->C6H5O- | |
| D. | 常温下电离常数:Ka2(H2CO3)>Ka(C6H5OH)>Ka (HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
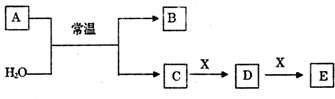
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3=NH4++NO3- | B. | CH3COOH=H++CH3COO- | ||
| C. | NH3•H2O?NH4++OH- | D. | NaHCO3=Na++HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com