
【题目】设NA为阿伏加德罗常数的数值.下列说法错误的是
A. 8.4g NaHCO3固体中含有的离子总数为0.3NA
B. 标准状况下,13.8gNO2与水充分反应转移的电子数目为0.2NA
C. 1L 1molL﹣1的NaClO溶液中ClO-的数目小于NA
D. 常温常压下,23g Na与O2充分反应,生成Na2O和Na2O2混合物时,转移电子总数为NA
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
A. 反应向逆反应方向进行
B. 反应向某方向进行一段时间后c(H2)<0.2 mol/L
C. 若升温后,K减小,说明该反应是吸热反应
D. 反应向某方向进行一段时间后K<57.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. c(OH-)/ c(NH3·H2O) B. c(NH![]() )/ c(OH-)
)/ c(OH-)
C. c(NH3·H2O)/ c(NH![]() ) D. c(OH-)
) D. c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C. N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
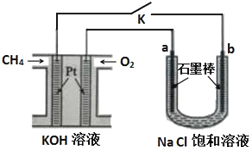
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.05mol/LH2SO4溶液的pH=______ ,0.01mol/LNaOH溶液的pH=______ 。
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=_______;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ![]() Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行
B.铅蓄电池在放电过程中,溶液的PH值增加
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。
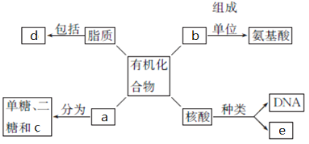
(1)小麦种子中的储能物质c是__________,人和动物细胞中的储能物质c是____________。
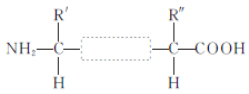
(2)两个氨基酸发生脱水缩合反应时,产物是__________和__________,下图方框内的结构简式是____________。
(3)b结构的多样性决定其功能的多样性,如作为结构物质、免疫功能、___________、___________、信息传递等。
(4)SARS病毒的遗传信息贮存在e中,e物质初步水解的产物是________________;在小麦叶肉细胞中,e主要存在于____________中。
(5)d中构成生物膜的主要是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com