
【题目】将24.4gNaOH固体溶于水,配成100mL溶液,其密度为1.22g/mL,请回答下列问题。
(1)从该溶液中取出10mL,其中NaOH的物质的量浓度为________,NaOH的质量分数为___________,溶液的密度为________,含NaOH的物质的量为_________;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_______。
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
【答案】6.1mol/L 20% 1.22g/mL 0.061mol 0.61mol/L 6:3:2
【解析】
(1)根据物质的量与质量或与物质的量浓度的计算公式计算,根据溶液稀释公式分析。
(2)根据反应过程中离子之间的比例关系分析。
(1)24.4gNaOH的物质的量为24.4g÷40g/mol=0.6mol,其物质的量浓度为0.61mol÷0.1L=6.1mol/L;溶液的质量为1.22g/mL×100mL=122g,质量分数为![]() =20%;溶液的密度为1.22g/mL;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为原来的十分之一,即为0.61mol/L,其中氢氧化钠的物质的量是0.061mol;
=20%;溶液的密度为1.22g/mL;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为原来的十分之一,即为0.61mol/L,其中氢氧化钠的物质的量是0.061mol;
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,反应的硫酸根离子物质的量相同,所以Na2SO4、KAl(SO4)2、Fe2(SO4)3三种物质的物质的量比为:1:1/2:1/3=6:3:2。


科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A. 6︰9︰0 B. 3︰3︰2 C. 6︰7︰3 D. 3︰4︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法正确的是( )
A. 从有机物分类看,它可属于“氨基酸类”“酯类”“芳香烃类”
B. 它能与盐酸反应,但不能与苛性钠溶液反应
C. 甲酸丁酯基(—COOC4H9)有3种不同结构
D. 它的分子式为C11H15NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
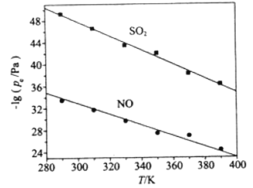
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32 2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是 ( )
A. H2O与BeCl2为角形(V形) B. CS2与SO2为直线形
C. SO3与CO![]() 为平面三角形 D. BF3与PCl3为三角锥形
为平面三角形 D. BF3与PCl3为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)

下列关于元素R的判断中一定正确的是( )
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com