
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| D. | 最理想的“原子经济”就是原子利用率为100% |
分析 A.汽车尾气污染物中含有氮的氧化物由氮气和氧气反应生成;
B.含磷污水可导致水体污染;
C.石灰乳呈碱性;
D.原子经济从原子的利用率的角度考虑.
解答 解:A.汽车尾气污染物中含有氮的氧化物是因为在高温下,由氮气和氧气反应生成,故A错误;
B.含磷污水可导致水体污染,造成水体富营养化,导致水华、赤潮等,故B错误;
C.石灰乳呈碱性,不能改变碱性土壤,故C错误;
D.原子利用率为100%,符合绿色化学的要求,为最理想的“原子经济”,故D正确.
故选D.
点评 本题考查较为综合,涉及环保等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:实验题
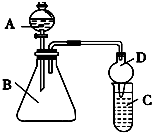
 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
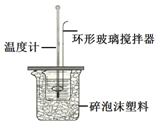 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂是因为其气化时可放出大量的热 | |
| B. | 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 | |
| C. | 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 | |
| D. | 久置的漂白粉变质是因为漂白粉与空气中的O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com