
(1)实验室制取Cl2的化学方程式为 .
(2)工业上电解饱和食盐水制取氯气,该反应的化学方程式为 .在接电源 (填“正”或“负”)极的电极上可以收集到Cl2.
考点:
化学方程式的书写;电解原理;氯气的化学性质.
专题:
元素及其化合物.
分析:
(1)二氧化锰与浓盐酸加热反应生成氯气;
(2)电解饱和食盐水反应生成NaOH、H2、Cl2,氯离子在阳极失电子.
解答:
解:(1)实验室中用二氧化锰与浓盐酸加热反应制取Cl2,其反应为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)电解饱和食盐水反应生成NaOH、H2、Cl2,该反应为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,电解时,氯离子在阳极失电子生成氯气,所以在连接电源正极的电极上生成氯气;
2NaOH+H2↑+Cl2↑,电解时,氯离子在阳极失电子生成氯气,所以在连接电源正极的电极上生成氯气;
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;正.
2NaOH+H2↑+Cl2↑;正.
点评:
本题考查氯气的性质及化学反应方程式的书写、电解原理的应用,明确电解池中两极上的反应原理即可解答,题目较简单.


科目:高中化学 来源: 题型:
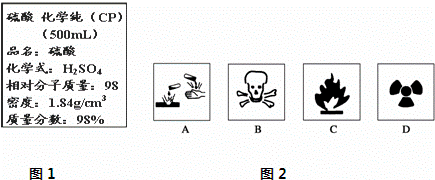
Ⅰ.现欲用该浓硫酸配制成1mol/L的稀硫酸.现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是 .
(3)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 .
(4)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是BCF.
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
Ⅱ.
(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的A.
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度 9.2mol/L(填>、<、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
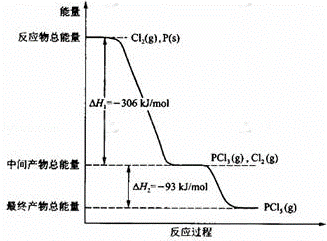
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是: ;
(2)PCl5分解成PCl3和Cl2的热化学方程式是: ;
上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于25%;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H 3= ,P和Cl2一步反应生成1mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中现象、结论均正确的是( )
| 操作 | 现象 | 结论 | |
| A | 甲和乙用导线连接插入稀盐酸溶液中 | 乙溶解,甲上有H2气放出 | 金属甲比乙活泼性强 |
| B | 向一无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I﹣ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3弱 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH90%.现将1.00g样品加入46.00mL1.00mol/L的盐酸中,过量的酸用1.070mol/LKOH溶液刚好中和.蒸发溶液,蒸发到无水时,可得到固体的质量约为( )
|
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行下列实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到0.04mol气体;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g;根据上述实验,推测100mL该溶液中一定存在的离子以及计算这些离子的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电池的说法不正确的是()
A. 手机上用的锂离子最池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2+2NaOH→NaNO3+NaNO2+H2O;NO2+NO+2NaOH→2NaNO2+H2O).现有由amolNO、bmolNO2、cmolN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为()
A.  mol•L﹣1 B.
mol•L﹣1 B. 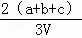 mol•L﹣1
mol•L﹣1
C. 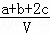 mol•L﹣1 D.
mol•L﹣1 D.  mol•L﹣1
mol•L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com