
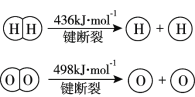
【题目】已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJmol1
下列说法不正确的是
A.该反应可作为氢氧燃料电池的反应原理
B.破坏1 mol H-O键需要的能量是463.4 kJ
C.H2的燃烧热ΔH<-241.8 kJ·mol1
D.H2(g)中的H-H键比H2O(g)中的H-O键牢固
【答案】D
【解析】
反应热等于所有反应物的键能总和减去所有生成物的的键能总和。
A.放热的氧化还原反应可设计成原电池,因此该反应可作为氢氧燃料电池的反应原理,A正确;
B.焓变等于断裂化学键吸收的能量减去形成化学键释放的能量,则2436 kJ +498 kJ -4E(H-O)=-483.6,解得E(H-O)=463.4 kJ ,B正确;
C.由已知反应得到H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol1,而燃烧热是在1个标准大气压下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水要为液态,但反应中生成的水为气态,若转化为液态还要放出热量,即H2的燃烧热ΔH<-241.8kJ·mol1,C正确;
O2(g)=H2O(g) ΔH=-241.8kJ·mol1,而燃烧热是在1个标准大气压下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水要为液态,但反应中生成的水为气态,若转化为液态还要放出热量,即H2的燃烧热ΔH<-241.8kJ·mol1,C正确;
D.键能越大,键越牢固,由题可知,E(H-H)=436 kJ·mol1,E(H-O)=463.4 kJ·mol1,故E(H-O)>E(H-H),则H2O(g)中的H-O键更牢固,D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,其质谱图如图所示,则:
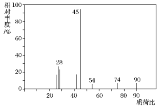
(1)C的分子式是___。
(2)若C能与NaHCO3溶液发生反应,则C中一定含有的官能团名称是_____。又知C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是_____。写出C与NaHCO3溶液反应的化学方程式__。
(3)0.1molC与足量Na反应,在标准状况下产生H2的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用燃烧法分析有机物的组成与结构。某化合物样品在足量O2中充分燃烧,生成物只有CO2和H2O。燃烧产物依次经过浓硫酸和碱石灰充分吸收,浓硫酸和碱石灰依次增重7.2g和17.6g。有关该物质的组成和结构推测不合理的是( )
A.该物质可能是烃类化合物
B.该物质结构中可能含C=C
C.该物质结构中可能含苯环
D.该物质结构中可能含羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)Z在周期表中的位置为______________。
(2)Y元素形成的离子的结构示意图为____________。
(3)X、Y、Z三种元素对应的原子半径大小关系为____________(填元素符号)。
(4)X和Z形成的简单氢化物,热稳定性较好的是______________(填化学式)。
(5)Y与X的最高价氧化物在一定条件下反应的实验现象是___________________________。
(6)下列说法正确的是_______。
A.W的氧化物,均满足8e—稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(7)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
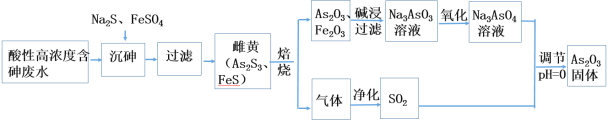
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
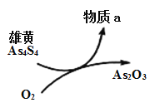
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
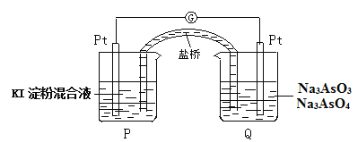
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com