
| A. | NH4H是离子化合物,含有离子键和共价键 | |
| B. | NH4H与水反应时,NH4H是还原剂 | |
| C. | NH4H投入少量的水中,有两种气体产生 | |
| D. | NH4H溶于水,所形成的溶液成酸性 |
分析 NH4H与氯化铵的结构相似,是由NH4+和H-构成的离子化合物,与水反应生成氨气和氢气,结合H元素的化合价变化分析.
解答 解:A.NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为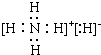 ,含离子键和共价键,故A正确;
,含离子键和共价键,故A正确;
B.NH4H与水反应时,生成氢气,由H元素的化合价变化可知NH4H是还原剂,故B正确;
C.NH4H固体投入少量水中,可生成NH3和H2,故C正确;
D.NH4H溶于水,生成氨气溶于水,所形成的溶液成碱性,故D错误;
故选D.
点评 本题考查氧化还原反应及化学键,为高频考点,注意元素化合价的判断为解答该题的关键,根据元素化合价的变化判断物质在反应中具有的性质,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| B. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 2.24LNH3和CH4的混合气体,所含电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: 、CH2Cl-CH2Cl、 、CH2Cl-CH2Cl、 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现四组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-2m | B. | 2m-n | C. | 8+n-2m | D. | 2m-n-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
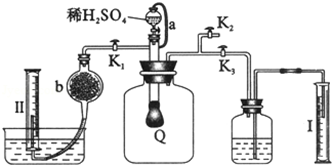
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
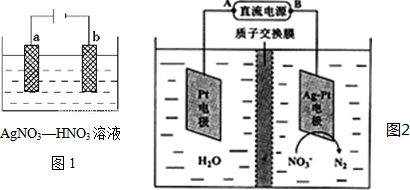
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
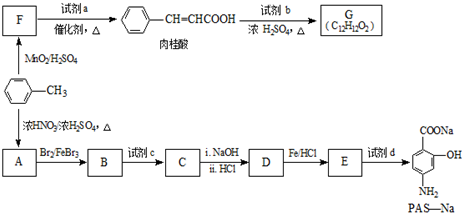
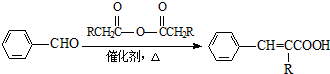 (R=-CH3或-H)
(R=-CH3或-H)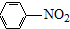 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$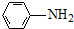
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$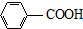
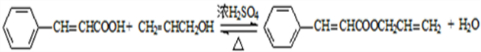
 生成A的反应类型是取代反应或硝化反应.
生成A的反应类型是取代反应或硝化反应.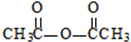 .
.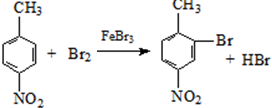 .
. .
.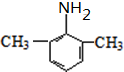 (写出其中一种结构简式).
(写出其中一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
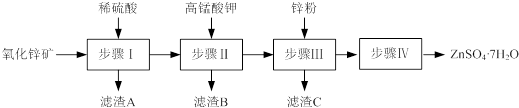
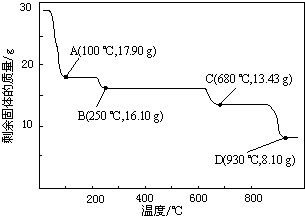
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com