
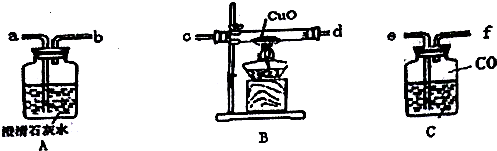
分析 组装一套CO还原CuO的实验装置,则将水重新注入装置C中而将CO气体排出,从长导管注入水,CO从f口出,然后连接c,d连接a,石灰水变浑浊可知生成CO2,因CO不纯时加热可能发生爆炸,则先通入CO排出空气后,再加热,以此来解答.
解答 解:组装一套CO还原CuO的实验装置,则将水重新注入装置C中而将CO气体排出,从长导管注入水,CO从f口出,然后连接c,d连接a,石灰水变浑浊可知生成CO2,因CO不纯时加热可能发生爆炸,则先通入CO排出空气后,再加热,
(1)由上述分析可知,使用CO气体进行实验时,可将水重新注入装置C中而将CO气体排出,此时水应从接口e流入,实验时气体则依次通过f→c→d→a,
故答案为:e;f;a;
(2)实验开始时应该先通入一氧化碳,后进行加热反应,原因是CO有可燃性,不纯易发生爆炸,
故答案为:通入一氧化碳;进行加热反应;CO有可燃性,不纯易发生爆炸;
(3)B处发生反应的化学方程式为CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,故答案为:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 负极是铝失电子被氧化 | |
| B. | 电池工作时,电流由铝电极沿导线流向铂电极 | |
| C. | 以网状的铂为正极,可增大与氧气的接触面积 | |
| D. | 该电池通常只需更换铝板就可继续使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| C. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2=HCO3- | |
| D. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-=NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.5个氧分子 | B. | 摩尔质量是32g/mol | ||
| C. | 含有3.01×1023个氧分子 | D. | 质量是16g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com