
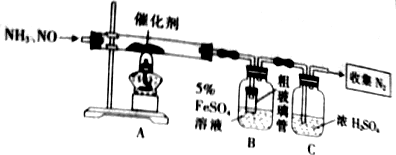
分析 (1)实验室用加热氯化铵和氢氧化钙固体方法制取氨气;
(2)配制5%FeSO4溶液在溶解固体时,需要用到玻璃棒搅拌;
(3)氨气易溶于水,导管直接插入硫酸亚铁溶液中容易发生倒吸;生成的氮气中含有水蒸气,应进行干燥;
(4)硫酸亚铁与一水合氨反应生成氢氧化亚铁白色沉淀和铵根离子;
(5)氨气与一氧化氮反应的化学方程式6NO+4NH3=5N2+6H2O,依据方程式计算解答.
解答 解:(1)实验室制取氨气是用氯化铵和氢氧化钙固体加热生成氨气和氯化钙、水,其化学方程式是:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)配制5%FeSO4溶液在溶解固体时,需要用到玻璃棒搅拌,所以还缺少的仪器:玻璃棒;
(3)氨气易溶于水,导管直接插入硫酸亚铁溶液中容易发生倒吸,所以装置B中粗玻璃管的作用是防止氨气易溶于水发生倒吸;
生成的氮气中含有水蒸气,通过盛有浓硫酸的洗气瓶可以吸收氮气中的水蒸气;
故答案为:防止氨气易溶于水发生倒吸;干燥;
(4)硫酸亚铁与一水合氨反应生成氢氧化亚铁白色沉淀和铵根离子,离子方程式:Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+;
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+;
(5)氨气与一氧化氮反应的化学方程式6NO+4NH3=5N2+6H2O,
则:6NO+4NH3=5N2+6H2O
6 5
V 2.016L
解得V=2.4129L;
则装置A中NO的转化率为:$\frac{2.4129L}{2.688L}$×100%=90%;
故答案为:90%.
点评 本题通过NO的转化率测定实验,考查了氨气的实验室制备原理、氨气、一氧化氮的性质,明确实验原理及物质的性质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
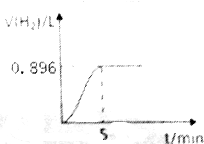 取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:
取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
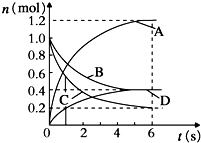 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 0~1s内,v(A)=v(c) | |
| C. | 0~6s内,B的平均反应速率为0.05mol/(L•s) | |
| D. | 0~6s内,各物质的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮气的转化率减小 | |
| B. | 氢气的转化率增大 | |
| C. | 氨气在平衡混合气体中的百分含量一定增大 | |
| D. | 氨气的分解速率大于氨气的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以A表示的平均反应速率为0.1 mol•L-1•s-1 | |
| B. | 平衡时,B的浓度为1 mol•L-1 | |
| C. | n值等于1 | |
| D. | 平衡时B的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | B. | N4与N2互为同素异形体 | ||
| C. | N4沸点比P4(白磷)高 | D. | N4气体转变为N2将吸收热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com