
【题目】实验室采用气相还原法制备纳米级Fe,其流程如图所示:
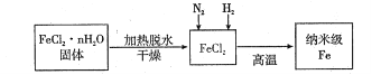
(1)纳米级Fe和稀盐酸反应的离子方程式为__________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为_________________。
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
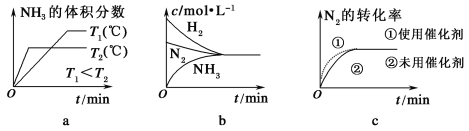
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组用某种粗盐进行提纯实验,步骤如图所示:已知粗盐中含有的杂质离子主要为:Mg2+、Ca2+、Fe3+、SO42-。
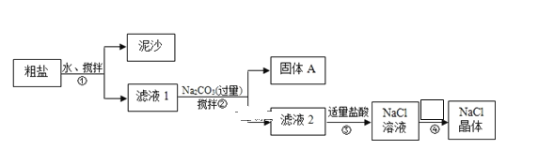
(1)步骤①和②的操作名称是___,所需要玻璃仪器为___。
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液,固体A是:___、___、Fe(OH)3 、BaSO4、BaCO3 (用化学式表示)
(3)步骤②中检验SO42-沉淀完全的操作是:___;
(4)步骤③中加入盐酸的作用是(用离子方程式表示)___;
(5)步骤④的操作为:___、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 molL-1
B. 配制200 mL 4.6 molL-1的稀硫酸需取该硫酸25 mL
C. 该硫酸与等体积的水混合后所得溶液浓度为9.2 molL-1
D. 该硫酸与等体积水混合后质量分数大于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
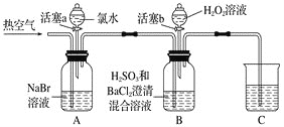
实验记录如下:
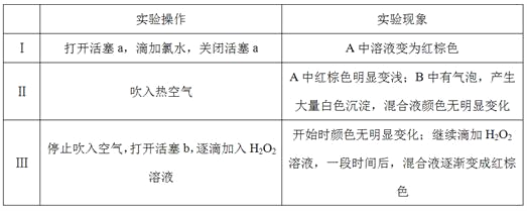
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com