
离子方程式:RO3n﹣+3S2﹣+6H+═R﹣+3S↓+3H2O.由此可知在RO3n﹣中,元素R的化合价是()
A. +4 B. +5 C. +6 D. +7
科目:高中化学 来源: 题型:
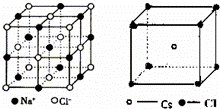
认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )
|
| A. | NaCl和CsCl都属于AB型的离子晶体 |
|
| B. | NaCl和CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子的配位数相等 |
|
| C. | NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8 |
|
| D. | NaCl和CsCl都属于AB型的离子晶体,所以阴、阳离子半径比相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于O2与O3气体,下列比值一定为2:3的是()
A. 若两种气体所占体积相同,两种气体的质量之比
B. 若两种气体原子数相同,两种气体的质子数之比
C. 若温度及压强相同,两种气体的密度之比
D. 若两种气体的质量相同,两种气体的分子数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸根,则原混合溶液中钾离子的浓度为()
A. 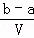 mol/L B.
mol/L B. 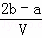 mol/L C.
mol/L C. 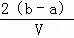 mol/L D.
mol/L D. 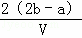 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用KMnO4与密度为1.19g•cm﹣3,溶质质量分数为36.5%的HCl溶液反应制取氯气,反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法分析电子转移的方向和数目(直接在上述方程式中表示).
(2)若反应中有0.5mol电子转移,被氧化的HCl的物质的量是 mol;
(3)c(HCl)= ;
(4)取上述盐酸0.1L与15.8gKMnO4充分反应,生成标况下的Cl2的体积V(Cl2)= L.
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验兴趣小组按如图装置实验后,所记录内容合理的是()
实验
记录 ①Cu为正极,Zn为负极;
②Zn质量减少,Cu质量不变;
③SO42﹣ 向Cu极移动;
④电子流方向是:由Zn经导线流入Cu片;
⑤Zn电极发生还原反应;
⑥正极反应式:Cu2++2e﹣═Cu

A. ①④⑥ B. ②③④ C. ①②⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
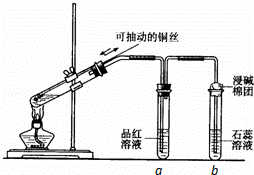
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: .
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.
试管a中的现象是 ,作用是 .
试管b中的现象是 ,作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com