
·ÖĪö £Ø1£©¢ŁÖ»ŅŖĖµĆ÷Ņ»Ė®ŗĻ°±ŌŚĖ®ČÜŅŗÖŠ²æ·ÖµēĄė¾ĶÄÜÖ¤Ć÷Ņ»Ė®ŗĻ°±ŹĒČõ¼ī£¬æÉŅŌøł¾ŻŅ»¶ØÅضČČÜŅŗµÄpH”¢ĒæĖįļ§ŃĪµÄĖį¼īŠŌµČ·ÖĪöÅŠ¶Ļ£»
¢ŚŹ¹°±Ė®µēĄė³Ģ¶ČŌö“󣬼ÓĖ®”¢¼ÓÓėļ§øłĄė×Ó»ņĒāŃõøłĄė×Ó·“Ó¦µÄĪļÖŹ”¢»ņÉżøßĪĀ¶Č£»
£Ø2£©¢Ł“×ĖįĪŖČõĖį£¬ŃĪĖįĪŖĒæĖį£¬µČÅØ¶ČŹ±“×ĖįµÄpH“ó£»
¢ŚĖįŗĶ¼ī¶¼¶ŌĖ®µÄµēĄėĘšŅÖÖĘ×÷ÓĆ£¬Ėį”¢¼īŠŌŌ½Ē棬Ė®µÄµēĄė³Ģ¶ČŌ½Š”£»
¢Ū“×ĖįÄĘĻŌŹ¾¼īŠŌ£¬ĀČ»ÆÄĘĻŌŹ¾ÖŠŠŌ£»
¢Ü0.1mol•L-1 NaOHČÜŅŗ10mLŗĶČÜŅŗĢå»żĪŖ20.00mL0.1mol•L-1µÄ“×Ėį·“Ó¦£¬µĆµ½µÄŹĒ“×ĖįŗĶ“×ĖįÄʵĻģŗĻĪļ£¬¾Ż“ĖČ·¶ØĄė×ÓÅØ¶Č“óŠ”£»
£Ø3£©½«0.2mol/L HClČÜŅŗÓė0.2mol/L°±Ė®ČÜŅŗµČĢå»ż»ģŗĻµĆµ½NH4Cl£¬»ģŗĻČÜŅŗ³ŹĖįŠŌ£¬øł¾ŻµēŗÉĪļĮĻŹŲŗć¼ĘĖć£»
£Ø4£©¢ŁŃĒĢśĄė×ÓŗĶļ§øłĖ®½ā¾łĻŌĖįŠŌ£¬ŃĒĢśĄė×ÓĖ®½āŅÖÖĘļ§øłµÄĖ®½ā£¬£ØNH4£©2Fe£ØSO4£©2ČÜŅŗÖŠc£ØNH4+£©ÉŌ“ó£¬ŅŌ“Ė½ā“šøĆĢā£»
¢ŚĀČ»ÆŅų±„ŗĶČÜŅŗÖŠ“ęŌŚ³ĮµķČܽāĘ½ŗā£¬AgCl£Øs£©?Ag+£Øag£©+Cl-£Øag£©£¬½įŗĻc£ØAg+£©»ņc£ØCl-£©¶ŌČܽāĘ½ŗāŅĘ¶ÆµÄÓ°Ļģ½ā“š£®
½ā“š ½ā£ŗ£Ø1£©¢ŁA£®³£ĪĀĻĀ£¬0.1mol•L-1°±Ė®pHĪŖ11£¬ČÜŅŗ³ŹĖįŠŌ£¬ĖµĆ÷Ņ»Ė®ŗĻ°±²æ·ÖµēĄė£¬ŌņĖµĆ÷Ņ»Ė®ŗĻ°±ŹĒČõµē½āÖŹ£¬¹ŹAÕżČ·£»
B£®°±Ė®ŗĶĀČ»ÆŃĒĢś·“Ӧɜ³ÉĒāŃõ»ÆŃĒĢś³Įµķ£¬ĖµĆ÷Ņ»Ė®ŗĻ°±ŹĒ¼ī£¬µ«²»ÄÜĖµĆ÷Ņ»Ė®ŗĻ°±²æ·ÖµēĄė£¬ĖłŅŌ²»ÄÜĖµĆ÷ŹĒČõµē½āÖŹ£¬¹ŹB“ķĪó£»
C£®³£ĪĀĻĀ£¬0.1mol/LµÄĀČ»Æļ§ČÜŅŗpHŌ¼ĪŖ5£¬ČÜŅŗ³ŹĖįŠŌ£¬ĖµĆ÷ĀČ»Æļ§ŹĒĒæĖįČõ¼īŃĪ£¬ŌņĖµĆ÷Ņ»Ė®ŗĻ°±ŹĒČõµē½āÖŹ£¬¹ŹCÕżČ·£»
D£®ļ§ŃĪŹÜČČŅ×·Ö½āĖµĆ÷ļ§ŃĪ²»ĪČ¶Ø£¬²»ÄÜĖµĆ÷Ņ»Ė®ŗĻ°±²æ·ÖµēĄė£¬Ōņ²»ÄÜĖµĆ÷Ņ»Ė®ŗĻ°±ŹĒČõµē½āÖŹ£¬¹ŹD“ķĪó£»
¹Ź“š°øĪŖ£ŗAC£»
¢ŚA£®¼ÓČėÉŁĮæĀČ»ÆĢś¹ĢĢ壬»įĻūŗÄĒāŃõøłĄė×Ó£¬Ōņ“Ł½ųŅ»Ė®ŗĻ°±µÄµēĄė£¬µēĄė³Ģ¶ČŌö“󣬹ŹAÕżČ·£»
B£®ĶØČė°±Ęų£¬°±Ė®µÄÅضČŌö“󣬵ēĄė³Ģ¶Č¼õŠ”£¬¹ŹB“ķĪó£»
C£®¼ÓČėÉŁĮæĀČ»Æļ§¹ĢĢ壬ļ§øłĄė×ÓÅضČŌö“ó£¬ŅÖÖĘ°±Ė®µÄµēĄė£¬µēĄė³Ģ¶Č¼õŠ”£¬¹ŹC“ķĪó£»
D£®¼ÓĖ®Ļ”ŹĶ£¬“Ł½ųŅ»Ė®ŗĻ°±µÄµēĄė£¬µēĄė³Ģ¶ČŌö“󣬹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗAD£»
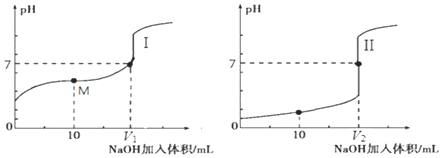
£Ø2£©¢ŁÓÉĶ¼ÖŠĪ“¼ÓNaOHŹ±µÄpHæÉÖŖ£¬Ķ¼¢ńÖŠĖįµÄpH“óÓŚ1£¬Ķ¼¢ņÖŠĖįµÄpH=1£¬ĖµĆ÷¢ņĪŖ0.1mol/LµÄŃĪĖįČÜŅŗ£¬ĪŖ“×ĖįČÜŅŗµĪ¶Ø¹ż³Ģ£¬ĖłŅŌµĪ¶Ø“×ĖįµÄĒśĻߏĒI£¬
¹Ź“š°øĪŖ£ŗI£»
¢Ś0.1mol•L-1 NaOHČÜŅŗ”¢0.1mol•L-1µÄŃĪĖįÖŠĒāĄė×ÓŗĶĒāŃõøłÅØ¶Č¶¼ŹĒ0.1mol/L£¬¶ŌĖ®µÄŅÖÖĘ×÷ÓĆŅ»Ńł£¬µ«ŹĒ0.1mol/L“×ĖįČÜŅŗÖŠĒāĄė×ÓÅØ¶ČŠ”ÓŚ0.1mol/L£¬ĖłŅŌ¶ŌĖ®µÄµēĄėŅÖÖĘ½ĻŠ”£¬¼“ČżÖÖČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc£ØH+£©×ī“óµÄŹĒ0.1 mol•L-1“×ĖįČÜŅŗ£¬¹Ź“š°øĪŖ£ŗ0.1mol•L-1“×ĖįČÜŅŗ£»
¢Ū“×ĖįŗĶĒāŃõ»ÆÄĘÖ®¼äµÄ·“Ó¦£¬µ±Ē”ŗĆĶźČ«·“Ó¦µĆµ½µÄ“×ĖįÄĘĻŌŹ¾¼īŠŌ£¬ŅŖŹ¹µĆČÜŅŗĻŌŹ¾ÖŠŠŌ£¬pH=7£¬ŠčŅŖ“×ĖįÉŌ¹żĮ棬ĖłŅŌŃĪĖįŗĶĒāŃõ»ÆÄĘĒ”ŗĆĶźČ«·“Ó¦£¬µĆµ½µÄĀČ»ÆÄĘĻŌŹ¾ÖŠŠŌ£¬ĖłŅŌV1£¼V2£¬¹Ź“š°øĪŖ£ŗ£¼£»
¢ÜÓĆ0.1mol•L-1 NaOHČÜŅŗ10mLŗĶČÜŅŗĢå»żĪŖ20.00mL0.1mol•L-1µÄ“×Ėį·“Ó¦£¬µĆµ½µÄŹĒ“×ĖįŗĶ“×ĖįÄʵĻģŗĻĪļ£¬ĻŌŹ¾ĖįŠŌ£¬“ĖŹ±Ąė×ÓÅØ¶Č“óŠ”c£ØCH3COO-£©£¾c £ØNa+£©£¾c £ØH+£©£¾c £ØOH-£©£¬¹Ź“š°øĪŖ£ŗc£ØCH3COO-£©£¾c £ØNa+£©£¾c £ØH+£©£¾c £ØOH-£©£»
£Ø3£©øł¾ŻµēŗÉŹŲŗćµĆc£ØCl-£©+c£ØOH-£©=c£ØNH4+£©+c£ØH+£©£¬ĪļĮĻŹŲŗćc£ØNH4+£©+c£ØNH3©qH2O£©=0.1mol/L=c£ØCl-£©£¬
ĖłŅŌc£ØH+£©-c£ØNH3©qH2O£©=c£ØOH-£©=10-8mol/L£¬
¹Ź“š°øĪŖ£ŗ10-8£»
£Ø4£©¢Ł£ŗ£ØNH4£©2Fe£ØSO4£©2ÖŠNH4+ŗĶFe2+¶¼Ė®½ā³ŹĖįŠŌ£¬Ė®½āĻą»„ŅÖÖĘ£¬Ņņ“Ė£ØNH4£©2Fe£ØSO4£©2ÖŠNH4+µÄĖ®½ā³Ģ¶Č£ØNH4£©2SO4µÄŅŖŠ”£¬£ØNH4£©2Fe£ØSO4£©2±Č£ØNH4£©2SO4µÄc£ØNH4+£©“ó£®
¹Ź“š°øĪŖ£ŗ£ØNH4£©2Fe£ØSO4£©2£»NH4+ŗĶFe2+¶¼Ė®½ā³ŹĖįŠŌ£¬Ė®½āĻą»„ŅÖÖĘ£»
¢ŚĀČ»ÆŅų±„ŗĶČÜŅŗÖŠ“ęŌŚ³ĮµķČܽāĘ½ŗā£ŗAgCl£Øs£©?Ag+£Øag£©+Cl-£Øag£©£¬ČÜŅŗÖŠc£ØAg+£©»ņc£ØCl-£©ÅضČŌ½“ó£¬AgClČܽā¶ČŌ½Š”£¬
¢Ł100mLÕōĮóĖ®ÖŠc£ØAg+£©=$\sqrt{1.8”Į10{\;}^{-10}}$mol/L£»
¢Ś100mL 0.3mol•L-1AgNO3ČÜŅŗ£¬c£ØAg+£©=0.3mol/L£»
¢Ū100mL0.1mol•L-1MgCl2ČÜŅŗÖŠ£¬c£ØCl-£©=0.2mol/L£¬c£ØAg+£©=9”Į10-10mol/L£»
c£ØAg+£©Óɓ󵽊”µÄĖ³ŠņĪŖ¢Ś£¾¢Ł£¾¢Ū£¬
¹Ź“š°øĪŖ£ŗ¢Ś£¾¢Ł£¾¢Ū£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éѧɜĖį¼īµĪ¶Ø”¢ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”±Č½Ļ”¢Ąė×ÓÅØ¶ČµÄ¼ĘĖćŅŌ¼°³ĮµķČܽāĘ½ŗāµÄÓ°ĻģŅņĖŲ·ÖĪöÅŠ¶ĻµÄÖŖŹ¶£¬ŹōÓŚ×ŪŗĻÖŖŹ¶µÄ漲飬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ÄŃ¶Č²»“ó£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 34SŌ×ÓŗĖÄŚÖŠ×ÓŹżĪŖ16 | B£® | 2H+µÄĖįŠŌ±Č1H+µÄĖįŠŌøüĒæ | ||
| C£® | 16OÓė18OµÄ»ÆѧŠŌÖŹ¼øŗõĶźČ«ĻąĶ¬ | D£® | 13CŗĶ15NŌ×ÓŗĖÄŚµÄÖŹ×ÓŹżĻą²ī2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 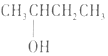 2--ōĒ»ł¶”Ķé 2--ōĒ»ł¶”Ķé | B£® | 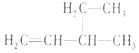 3--ŅŅ»ł--1--¶”Ļ© 3--ŅŅ»ł--1--¶”Ļ© | ||
| C£® | 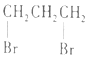 1£¬3--¶žäå±ūĶé 1£¬3--¶žäå±ūĶé | D£® | 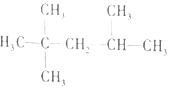 2£¬2£¬3--Čż¼×»łĪģĶé 2£¬2£¬3--Čż¼×»łĪģĶé |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | DNOP£ØĮŚ±½¶ž¼×Ėį¶žŠĮÖ¬£©ŹĒŅ»ÖÖÓÉĮŚ±½¶ž¼×ĖįŗĶÕżŠĮ“¼¾Ö¬»Æ·“Ó¦¶ųµĆµÄŅ»ÖÖõ„ĄąÓŠ»ś»ÆŗĻĪļ£¬³£ÓĆ×÷ŌöĖܼĮ”¢ČܼĮŅŌ¼°ĘųĻąÉ«Ę×¹Ģ¶ØŅŗ£¬¶ŌČĖĢåĪŽŗ¦£¬æÉÓĆ×÷Ź³Ę·Ģķ¼Ó¼Į | |
| B£® | ĀĮ¼°ĘäŗĻ½šŹĒµēĘų”¢¹¤Ņµ”¢¼Ņµ×¹ć·ŗŹ¹ÓĆµÄ²ÄĮĻ£¬ŹĒŅņĪŖĀĮµÄŅ±Į¶·½·Ø±Č½Ļ¼ņµ„ | |
| C£® | ĢÕ“É”¢×©Ķß”¢²£Į§”¢Ė®Äą¶¼ŹĒ¹čĖįŃĪ²śĘ· | |
| D£® | °×¾Ę±źĒ©ÉĻ×¢ÓŠ”°¾Ę¾«¶Č52%Vol”±×ÖŃł£¬Ėü±ķŹ¾100gøĆ°×¾ĘÖŠŗ¬ÓŠ52gČ÷¾« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol•L-1NH4NO3ČÜŅŗÖŠ£ŗc£ØNH4+£©£¾c£ØNO3-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| B£® | ČÜÓŠµČĪļÖŹµÄĮæNaClO”¢NaHCO3µÄČÜŅŗÖŠ£ŗc£ØHClO£©+c£ØClO-£©=c£ØCO32-£©+c£ØHCO3-£©+c£Ø H2CO3£© | |
| C£® | Ļņ10mL0.2mol•L-1NaClČÜŅŗÖŠµĪČė2mL0.1mol•L-1AgNO3ČÜŅŗ£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”¹ŲĻµ£ŗc£ØNa+£©£¾c£ØNO3-£©=c£ØCl-£©£¾c£ØAg+£© | |
| D£® | ³£ĪĀĻĀpH=2µÄ“×ĖįÓėpH=12µÄÉÕ¼īČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØNa+£©£¾c£ØCH3COO-£©£¾c£ØOH-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com