
设NA为阿佛加德罗常数的值,下列叙述正确的是
| A.常温下 ,4gCH4含有NA 个C-H共价键 |
| B.1 mol Fe 与足量的稀HNO3反应,转移2 NA个电子 |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
A
解析试题分析:A、4gCH4的物质的量为0.25mol.,1molCH4中含有4mol的C-H共价键,则0.25mol. CH4中含有1mol的C-H共价键,故4gCH4 含有NA 个C-H共价键,正确;B、1 mol Fe 与足量的稀HNO3 反应反应时Fe转化为Fe3+,转移的电子数应为3NA 个电子,错误;C、50mL 18.4mol/L浓硫酸与足量铜微热反应,若50mL 18.4mol/L浓硫酸完全反应,则生成的SO2分子数目为0.46NA,但由于反应过程中浓硫酸的浓度降低,变成稀硫酸,则Cu不能继续与稀硫酸反应,因此生成的SO2分子数目小于0.46NA,错误;D、若0.1molN2和0.3molH2恰好完全反应,则转移的电子数目为0.6NA,但由于合成氨的反应是可逆反应,不能进行到底,因此转移的电子数目小于0.6NA ,错误。
考点:以阿伏伽德罗常数为背景考查考查有关物质的量的计算、氧化还原反应、共价键、可逆反应。


科目:高中化学 来源: 题型:单选题
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度相同的是
| A.100 mL 0.5 mol/L MgCl2溶液 | B.200 mL 0.25 mol/L AlCl3溶液 |
| C.50 ml 1 mol/L NaCl溶液 | D.25 ml 0.5 mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列对摩尔(mol)的有关说法中错误的是
| A.摩尔是一个单位而非物理量 |
| B.摩尔既能用来计量纯净物,又能用来计量混合物 |
| C.1mol任何气体所含气体的分子数目都相等 |
| D.0.5mol氦约含有1.204×1024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的化学用语正确的是
①NH4H的电子式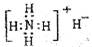
②硝基苯的结构简式: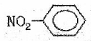
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: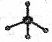
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子: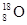
⑦sp2杂化轨道模型: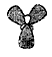
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
| A.0.02 mol/L | B.0.05 mol/L |
| C.0.25 mol/L | D.0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于CO的叙述正确的是( )
| A.CO的摩尔质量是28g |
| B.1mol CO中所含分子数为6.02×1023个 |
| C.1 mol CO的质量是28 g / mol |
| D.常温常压下,1 mol CO的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50mL 1mol/L NaCl溶液 | D.25mL 0.5mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com