
| A、12.0g NaHSO4晶体中阳离子和阴离子的总数为0.3NA | ||
B、14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为
| ||
| C、标准状况下,1L液态水中含有的H+数目为10-7NA | ||
| D、足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 12.0g |
| 120g/mol |
| m |
| M |
| 14g |
| 14n |
| 14g |
| 14n |
| NA |
| n |


科目:高中化学 来源: 题型:
A、分散质微粒的大小与分散系种类的关系: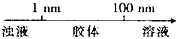 | ||
B、常温下溶液的pH其酸碱性的关系: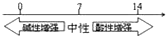 | ||
C、硫的化合物中化合价与其氧化性、还原性的关系: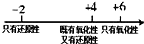 | ||
D、Fe在Cl2中燃烧的产物与
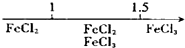 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况,1mol SO3含O原子个数为3NA | B、1.12L N2中含N2分子数为0.05NA | C、5.6g Fe与足量稀盐酸反应,转移的电子数为0.3NA | D、常温下pH=1的H2SO4溶液中,H+的浓度为0.20mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol丙烷含有的非极性共价键数目为NA | B、常温下,1.8g H2O含有的电子数为NA | C、25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | D、2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有2.7g Al参加反应后,溶液中AlO2-数目为0.1NA | B、每生成0.6mol H2,被还原的水分子数目为1.2NA | C、有6.72L H2生成时,反应中转移的电子数目为0.6NA | D、溶液中每增加0.1mol AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cu与足量硫反应转移的电子数为2 NA | B、在标准状况下,22.4L氟化氢中含有NA个分子 | C、氯化铁生成Fe(OH)3 胶体的离子方程式:Fe3++3H2O═Fe(OH)3↓+3H+ | D、在加入铝片能生成氢气的溶液中一定共存的离子组:Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | B、等物质的量的-CH3,CD3+,14CH3-的中子数之比为6:8:9 | C、向2mol/L 1L的氯化钙溶液中通入标况下22.4LCO2,理论上可以得到100g沉淀 | D、将CO2气体通入足量的过氧化钠中,固体增重28g,则该反应过程中转移电子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1.0 mol/L的NH4Al(SO4)2溶液中含有的氧原子数为8NA | B、25℃时PH=13的NaOH溶液中含有OH-的数目为0.1NA | C、标准状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | D、1mol FeCl3完全水解得到的Fe(OH)3胶体中含有的胶粒的数目为1NA |
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江苏省高二(文)上学期期中化学试卷(解析版) 题型:选择题
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com