
分析 已知HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,结合电子守恒可知,Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,
反应整个过程为HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为
n(O2)=$\frac{0.06mol}{4}$=0.015mol,V(O2)=0.015mol×22400ml/mol=336mL,所以通入O2的体积为336mL,
答:应通入O2336mL.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱 | B. | 食用醋 | C. | 氯化铵 | D. | 纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高CO2充气压力,饮料中c(A-)不变 | |
| B. | 当pH为5.0时,饮料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| D. | 结合H+的能力:A->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于3:8 | B. | 大于3:8 | C. | 小于或等于3:8 | D. | 大于3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③⑥ | C. | 只有② | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
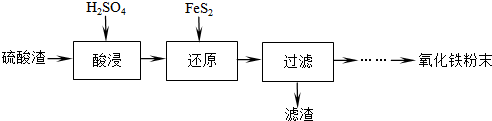
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com