
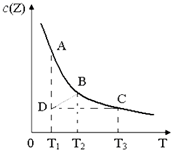
 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |
科目:高中化学 来源: 题型:
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、炼铁中加入焦炭作造渣剂 |
| B、炼钢中吹入氧气作氧化剂 |
| C、电解铝生产中加入冰晶石以降低氧化铝的熔点 |
| D、火法冶金比湿法冶金能耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠是淡黄色固体,可用于呼吸面具中作为氧气的来源 |
| B、氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 |
| C、碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 |
| D、质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阴极 |
| C、放电时电解质溶液的pH逐渐增大 |
| D、充电时每生成1 mol CH3OH转移12 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com