
| A.化学平衡发生移动,平衡常数必发生变化 |
| B.平衡常数发生变化,化学平衡必发生移动 |
| C.改变浓度,平衡常数一定改变 |
| D.催化剂改变达到平衡的时间,必引起平衡常数的改变 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ·mol
2NH3(g) ΔH=-92.4 kJ·mol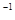 ):
):| | 反应物投入量 | NH3的浓度 (mol·L 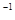 ) ) | 反应的 能量变化 | 体系压强 (Pa) | 反应物 转化率 |
| 甲 | 1mol N2、3mol H2 | c1 | 放出a kJ | p1 | α1 |
| 乙 | 2mol NH3 | c2 | 吸收b kJ | p2 | α2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是| A.①②③④ | B.②⑥⑨ | C.②⑥⑨⑩ | D.③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PCl3(g)+Cl2(g) ①
PCl3(g)+Cl2(g) ① H2(g)+I2(g) ②
H2(g)+I2(g) ② N2O4(g) ③
N2O4(g) ③| A.均不变 |
| B.均增大 |
| C.①增大,②不变,③减少 |
| D.①减少,②不变,③增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应 H2(g)+ I2(g) 2HI(g)达平衡, 加压后混合气体颜色变深 2HI(g)达平衡, 加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯水在光照条件下颜色变浅最终变为无色 |
| B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C.500 ℃时比室温更利于合成氨 |
| D.乙酸乙酯的合成中用浓硫酸比稀硫酸更有利于乙酸乙酯的生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H=" -92.6kJ/mol." 测得数据如下表
2NH3(g) △H=" -92.6kJ/mol." 测得数据如下表| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| (1) | 2 | 3 | 0 | 27.78kJ |
| (2) | 1.6 | 1.8 | 0.8 | Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
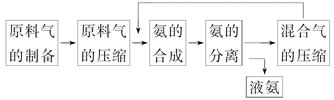
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com