
|
在4 mol/L的硫酸和2 mol/L的硝酸混合溶液10 mL中,加入0.96 g铜粉,充分反应后,最多可收集到标况下的气体的体积为 | |
A. |
89.6 mL |
B. |
112 mL |
C. |
168 mL |
D. |
224 mL |
科目:高中化学 来源: 题型:阅读理解


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8cV |
| m1 |
| 2.8cV |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
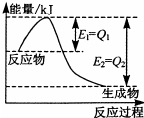 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.查看答案和解析>>
科目:高中化学 来源:甘肃省天水一中2011届高三第三次月考化学试题 题型:013
|
设NA为阿伏加德罗常数,下列说法一定正确的是 | |
| [ ] | |
A. |
在1 mol/L的FeCl3溶液中,Fe3+的个数小于NA |
B. |
1 mol单质铜与足量硫或氯气反应失去电子数均为2NA |
C. |
1 mol碳烯(:CH2)中含有电子数为8NA |
D. |
在标准状况下,22.4 L NO与11.2 L O2充分反应后,所得气体的分子数为NA |
查看答案和解析>>
科目:高中化学 来源:浙江省富阳市新登中学2012届高三上学期期中考试化学试题 题型:058
在食品加工领域
,应用二氧化硫的最主要原因是避免氧化和防腐.在我国葡萄酒中二氧化硫的最大使用量为0.2500 g/kg,二氧化硫残留量不得超过0.05000 g/kg.葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定SO2+2KOH以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12 g/ml)中二氧化硫的含量是否超标的实验方案.
实验步骤:
①用移液管量取50.00 ml样品于250 ml锥形瓶中,加入25.00 ml 1 mol/L氢氧化钾溶液,加塞,摇匀;
②静置15 min;
③打开塞子,加入25.00 ml 1∶3硫酸溶液使溶液呈酸性,再加入25.00 ml 0.01000 mol/L碘溶液,迅速的加塞,摇匀;
④用________滴定管移取步骤③中溶液25.00 ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000 mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论.
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是:________;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是________;
(3)步骤④的A溶液最合适的是________;滴定终点的判断方法是________;
(4)步骤④应该选用________(填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S2O3溶液的体积数据记录如下:

根据数据计算该样品中总二氧化硫的浓度为________mol/L,故该干白葡萄酒是________(填“合格”“不合格”)产品.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市松江区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I SO2+2H2O+I2→H2SO4+2HI
II 2HI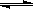 H2+I2
H2+I2
III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。

0—2min内的平均反应速率v(HI)=
_________ 。该温度下,反应2HI(g)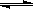 H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g)
+ Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g)
+ Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)

实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com