

分析 (1)①从氨、CO2曲线下降及氨基甲酸铵曲线升高看出第一步是快反应;从尿素曲线升高缓慢看出第二步是慢反应,总反应的快慢由慢的一步决定;
②依据热化学方程式和盖斯定律计算出该反应的焓变;
(2)催化剂改变反应速率不改变化学平衡;
(3)根据H++OH-=H2O知氢离子和氢氧根离子之间的关系式计算氢离子的物质的量浓度,再根据离子方程式定量关系计算铵根离子物质的量,据此计算此铵盐的摩尔质量判断属于的铵盐,结合判断出的化学式计算其质量分数;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
解答 解:(1)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,
故答案为:二;
②已知:①N2(g)+O2(g)=2NO(g)△H=a kJ•mol-1
②N2(g)+3H2(g)=2NH3(g)△H2=b kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=c kJ•mol-1
依据盖斯定律③×3-2×②-2×①得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3c-2a-2b)kJ/mol,
故答案为:(3c-2a-2b).
(2)合成氨反应N2(g)+3H2(g)=2NH3(g),使用催化剂只改变反应速率,不改变化学平衡,反应的△H不变,
故答案为:不改变;
(3)根据H++OH-=H2O知c(H+)=$\frac{0.1mol/L×0.025L}{0.01L}$=0.25mol/L,100mL溶液中氢离子的物质的量=0.25mol/L×0.1L=0.025mol,根据4NH4++6HCHO→(CH2)6N4+4H++6H2O,
得铵根离子的物质的量=0.025mol,若为硝酸铵物质的量也为0.025mol,M=$\frac{2g}{0.025mol}$=80g/mol,摩尔质量符合,若为硫酸铵或碳酸铵,物质的量为0.0125mol,摩尔质量M=$\frac{2g}{0.0125mol}$=160g/mol,所以判断此铵盐为硝酸铵,
硝酸铵盐中氮的质量分数$\frac{2×14}{80}$×100%=35%,
故答案为:35%;
(4)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查了化学平衡的影响因素分析、化学反应速率的影响因素判断、化学反应速率的计算,物质的量的有关计算等知识,题目难度中等,注意掌握化学平衡的影响因素、化学反应速率的计算方法,能够利用盖斯定律求算反应中的焓变.


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn和稀硝酸反应 Zn+2H+═Zn2++H2↑ | |
| B. | 鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| D. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蕊试剂滴入稀盐酸 | |
| B. | 酚酞试剂滴入氢氧化钠溶液 | |
| C. | 食盐溶液加水稀释 | |
| D. | 干燥的氯气通过刚采摘的红色的鲜花 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入BaCl2溶液中会产生白色沉淀 | |
| B. | 向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 | |
| C. | NO2和水反应时,NO2作氧化剂,水作还原剂 | |
| D. | SO2能使酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉和食盐的混合物 | B. | 石灰石与泥沙的混合物 | ||
| C. | 碘与酒精的混合物 | D. | 泥沙与氯化钠的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 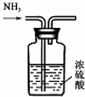 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 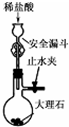 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
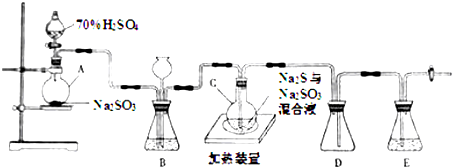
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com