
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
分析 反应的化学方程式为:N2O4?2NO2,由表可知,60s时反应达平衡,平衡时c(NO2)=0.120mol/L,N2O4的起始度为0.1mol/L,则:
N2O4(g)?2NO2(g)
起始(mol/L):0.1 0
变化(mol/L):0.06 0.12
平衡(mol/L):0.04 0.12,
以此计算各物理量.
解答 解:反应的化学方程式为:N2O4?2NO2,由表可知,60s时反应达平衡,平衡时c(NO2)=0.120mol/L,N2O4的起始度为0.1mol/L,则:
N2O4(g)?2NO2(g)
起始(mol/L):0.1 0
变化(mol/L):0.06 0.12
平衡(mol/L):0.04 0.12,
则达平衡时N2O4的转化率=$\frac{0.06}{0.1}×100%$=60%,
反应N2O4(g)?2NO2(g)的平衡常数=$\frac{0.1{2}^{2}}{0.04}$=0.36,
升高温度,容器中气体的颜色变深,说明升高温度平衡向生成NO2的方向移动,则反应2NO2(g)?N2O4(g)的△H<0,
在上述条件下,60s内N2O4的平均反应速率=$\frac{0.06mol/L}{60s}$=0.001 mol•L-1•s-1,
故答案为:60%;0.36;<;0.001 mol•L-1•s-1.
点评 本题考查了化学平衡的计算,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,注意掌握化学平衡的影响因素、平衡常数的概念及表达式,明确化学反应速率的计算方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
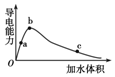 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时(s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=$\frac{0.01}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com