
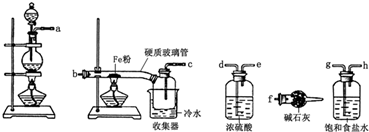
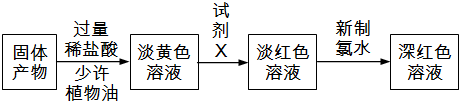


科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18 g?mol-1 |
| B、3.01×1023个SO2分子的质量为32 g |
| C、CH4的摩尔质量为16 g |
| D、1 mol任何物质均含有6.02×1023个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| 电解质 | 电离常数(mol?L-1) |
| H3PO4 | Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13 |
| HF | Ka=6.4×10-4 |
| CH3COOH | Ka=1.7×10-5 |
| NH3?H2O | Kb=1.7×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
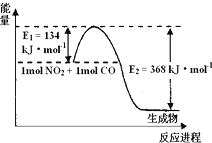 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com