
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。
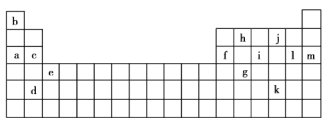
(1)a和c的I1大小关系是______大于______。(填字母)
(2)上述元素中,原子中未成对电子数最多的是______(填字母),写出该元素基态原子的核外电子排布式:______。
(3)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4570 | 1820 |
I3 | 11799 | 6920 | 2750 |
I4 | 9550 | 11600 |
①表中X可能为以上13种元素中的______(填字母)元素。用元素符号表示![]() 和j形成的一种化合物的化学式:______。
和j形成的一种化合物的化学式:______。
②Y是周期表中第______族元素。
③以上13种元素中,______(填字母)元素原子失去核外第一个电子需要的能量最多。
【答案】c a i ![]() (或[Ne]3s23p3) a
(或[Ne]3s23p3) a ![]() (或Na2O2) ⅢA m
(或Na2O2) ⅢA m
【解析】
由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Sr、e为Sc、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar,据此结合元素的核外排布与第一电离能的变化规律解答。
根据上述分析可知,
(1)a为Na,c为Mg,两者均属于属于第三周期,因同一周期中,元素原子的第一电离能随原子序数的增加呈增大趋势,故第一电离能I1:Mg大于Na,即为c大于a;
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,未成对电子最多,核外电子排布式为1s22s22p63s23p3(或[Ne]3s23p3),
故答案为:i;1s22s22p63s23p3(或[Ne]3s23p3);
(3)①由表中数据可以看出,锂和X的I1均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na,X和j形成的化合物的化学式为Na2O、Na2O2,
故答案为:a;Na2O(或Na2O2);
②由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素,
故答案为:ⅢA;
③以上13种元素中,Ar属于第三周期,原子最稳定的是Ar,故其I1最大,即元素原子失去核外第一个电子需要的能量最多,故答案为:m。


科目:高中化学 来源: 题型:
【题目】将4molN2O4放入2L恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:
2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:

(1)D点v(正)____v(逆)(填“>、<或=”)。
(2)A、B、C三点中平衡常数K的值最大的是____点。T2时N2O4的平衡转化率为____;若平衡时间为5s,则此时间内的N2O4平均反应速率为____。
(3)若其条件不变,在T3原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数____(填“增大、不变或减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
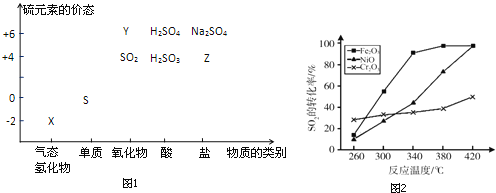
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含![]() 、
、![]() 、
、![]() 三种元素,其分子模型如图所示,该分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
三种元素,其分子模型如图所示,该分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
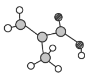
(1)该物质的结构简式为______。
(2)该物质中所含官能团的名称为______。
(3)下列选项中,与该物质互为同系物的是______(填序号,下同),互为同分异构体的是______。
①![]() ②
②![]()
③![]() ④
④![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙苯(![]() )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
(1)比异丙苯少2个碳原子的同系物的结构简式:__________。
(2)下列关于异丙苯说法错误的是____________(选填编号)
A 异丙苯的分子式为C9H12 B 异丙苯的沸点比苯低
C 异丙苯和苯为同系物 D 异丙苯中碳原子可能都处于同一平面
(3)鉴别异丙苯与苯的试剂、现象和结论:_____________。
(4)由苯与2-丙醇反应制备异丙苯属于____________反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为______________。
(5)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是____________。
(6)α-甲基苯乙烯是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到,写出由异丙苯制取该单体的另一种方法。_________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
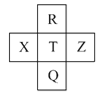
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
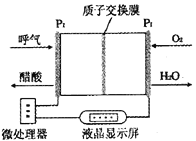
A.电流由O2所在的铂电极经外电路流向另-电极
B.该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2↑+12H+
C.O2所在的铂电极处发生还原反应
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且实验式与A相同,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。
A_____________________________;B_________________________。
(2)A、B中_________(填A、B的结构简式)存在同分异构体,同分异构体的名称是_______________________。(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧三种元素组成的有机物![]() 的相对分子质量为102,所含氢元素的质量分数为
的相对分子质量为102,所含氢元素的质量分数为![]() ,分子中氢原子数为氧原子数的5倍。
,分子中氢原子数为氧原子数的5倍。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,
中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,![]() 与氢气反应生成
与氢气反应生成![]() ,
,![]() 分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则
分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则![]() 的结构简式为______。
的结构简式为______。
(3)写出两个与![]() 具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com