
(每空2分,共10分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液法 B 加热分解 C 结晶法 D 分液法 E 蒸馏法 F 过滤法
(1) 分离饱和食盐水和沙子的混合物;
(2) 将溴水中的溴与水分离;
(3) 分离水和汽油;
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶);
(5) 分离水和氯化钠。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:2015-2016学年山东省临沂市高二上10月月考化学试卷(解析版) 题型:选择题
在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L﹣1.下列判断错误的是
xC(g)+2D(g).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L﹣1.下列判断错误的是
A.平衡常数约为0.3
B.B的转化率为40%
C.A的平均反应速率为0.3 mol·(L•min)﹣1
D.若混合气体的相对分子质量不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
某固体物质A在一定条件下受热分解产物都是气体,有关的化学方程式为:2A=B↑+2C↑+2D↑。若生成的混合气体对氘气的相对密度为d,则A的相对分子质量为
A.2d B.2.5d C.5d D.10d
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:填空题
元素周期表的用途广泛。
(1)用“>”或“<”填空:
离子半径 | 非金属性 | 熔点 | 沸点 |
K+_____S2- | N____O | 金刚石_____晶体硅 | HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液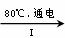 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
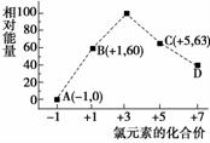
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下表中“实验操作”与“预期现象”对应关系正确的是
选项 | 试剂和操作 | 现象 |
A | 向AlCl3溶液中滴入过量的氨水 | 溶液先有白色沉淀,后来沉淀消失 |
B | 向新生成的AgC1浊液中滴入KI溶液,振荡 | 白色沉淀逐渐转化为黄色沉淀 |
C | 向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 | 溶液先变浑浊,通入CO2后品红的红色不褪去 |
D | 向BaC12溶液中先通入SO2,再通入过量NO2 | 先生成沉淀,后来沉淀消失 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(10分)已知反应:Fe(s)+CO2(g)  FeO(s)+CO(g)?H=akJ·mol?1
FeO(s)+CO(g)?H=akJ·mol?1
测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)该反应的化学平衡常数表达式为 ,若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则v(CO)为 。
(2)若在700℃时该反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号,下同)。不能增大化学反应速率的有 。
A.缩小反应容器的体积
B.通入适量CO2
C.加入适量铁
D.升高温度到900℃
E.使用合适的催化剂
(3)下列图像符合该反应的是 (填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。
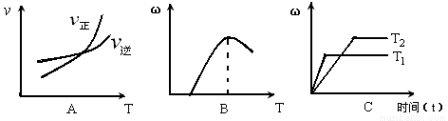
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:填空题
(11分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数这比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_________、_________;杂化轨道分别是__________、_________;a分子的立体结构是___________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体,_________晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________。
(4)Y与Z比较,电负性较大的_________,
(5)W元素的化学式__________,其+2价离子的核外电子排布式是___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知H2CO3的酸性比HClO的酸性强,对反应:Cl2+H2O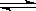 HCl+HClO达到平衡后 ,要使HClO浓度增加可加入
HCl+HClO达到平衡后 ,要使HClO浓度增加可加入
A.NaOH B.HCl C.CaCO3(固体) D.H2O
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和煤的液化均是物理变化
B.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
C.天然纤维和合成纤维的主要成分都是纤维素
D.海水淡化的方法有蒸馏法、电渗析法等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com