
【题目】下列离子方程式的书写正确的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O![]() +4Cl2+5H2O=2SO
+4Cl2+5H2O=2SO![]() +8Cl-+10H+
+8Cl-+10H+
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
【答案】A
【解析】
A.向Na2S2O3溶液中通入足量的氯气,反应生成硫酸钠、硫酸、HCl和水,该反应的离子方程式为:S2O32+4Cl2+5H2O═2SO42+8Cl+10H+,故A正确;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故B错误;
C.向碳酸氢铵溶液中加入足量石灰水,铵根离子和碳酸氢根离子都参与反应,正确的离子方程式为:NH4++HCO3+Ca2++2OH═CaCO3↓+H2O+NH3H2O,故C错误;
D.在海带灰的浸出液(含有I)中滴加H2O2得到I2,正确的离子方程式为:2I+H2O2+2H+=I2+2H2O,故D错误;
答案选A。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2)为原料生产钛白粉的工艺流程如图:
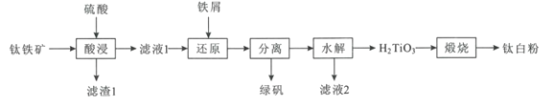
回答下列问题:
(1)“酸浸”是用硫酸在温度为150~200℃下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为___。
(2)“滤渣1”的主要成分有___。
(3)“还原"中加入过量铁屑的目的是___。
(4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4·7H2O)容易被氧化,则“分离”得到绿矾的操作为___。
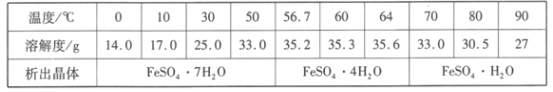
(5)“水解”需要加热至90℃的目的是___。
(6)“滤液2”可返回到___工序循环利用。
(7)工业上将钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体,反应的化学方程式为___,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
A.2v(正、HF)=v(逆、H2O)B.v(H2O)=2v(SiF4)
C.SiO2的质量保持不变D.反应物不再转化为生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空
(1)ARn+共有x个电子,则该阳离子的中子数________。
(2)AXn-共有x个电子,则该阴离子的中子数________。
(3)已知R原子有b个中子,R2+核外有a个电子,则R原子的组成符号是________。
(4)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为____________。
(5)已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则Wg R原子完全转化为R2-。其中含有的电子数为________(用NA表示阿伏伽德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(s)+O2(g)=SO2(g) ΔH1; S(g)+O2(g)=SO2(g) ΔH2
C.![]() ΔH1;C(s)+O2(g)=CO2(g) ΔH2
ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1; ![]() ΔH2
ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用你所学的化学知识回答下列问题:
(1)Na、Mg、Al中第一电离能最大的是___(填元素符号),Fe原子基态电子排布式为___。
(2)下列反应可用于检测司机是否酒后驾驶:2Cr2O![]() +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②1molCH3COOH分子含有σ键的数目为___NA。
③H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(3)S元素的最高价氧化物在气态时以单分子形式存在,中心原子的杂化方式为___杂化,其分子的立体构型为___。H2O、H2S、H2Se沸点由低到高的顺序___。
(4)将Cu的粉末加入浓氨水中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是___。
(5)金属元素X和非金属元素Y生成某化合物的晶胞如图(X用白球表示,Y用黑球表示),则该化合物的化学式为___。
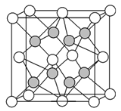
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。298K时,
。298K时,![]() ,
,![]() ,
,![]() 。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
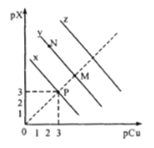
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(Cl-)
C.298K时增大M点的阴离子浓度,则y上的点向N点移动
D.298K时![]() 的平衡常数K的数量级为103或102
的平衡常数K的数量级为103或102
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com