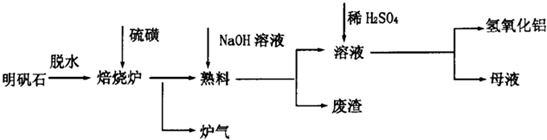
(2013?四川)明矾石经处理后得到明矾[KAl(SO
4)
2?12H
2O].从明矾制备Al、K
2SO
4、和H
2SO
4的工艺过程如图1所示:焙烧明矾的化学方程式为:4KAl(SO
4)
2?12H
2O+3S═2K
2SO
4+2Al
2O
3+9SO
2+48H
2O

请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
S
S
.
(2)从水浸后的滤液中得到K
2SO
4晶体的方法是
蒸发结晶
蒸发结晶
.
(3)Al
2O
3在一定条件下可制得AlN,其晶体结构如图2所示,该晶体中Al的配位数是
4
4
.
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)
2,该电池反应的化学方程式是
Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
.
(5)焙烧产生的SO
2可用于制硫酸.已知25℃、101kPa时:
2SO
2(g)+O
2(g)?2SO
3(g)△H
1=-197kJ/mol;
H
2O(g)?H
2O(l)△H
2=-44kJ/mol;
2SO
2(g)+O
2(g)+2H
2O(g)═2H
2SO
4△H
3=-545kJ/mol.
则SO
3(g)与H
2O(l)反应的热化学方程式是
①SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol
①SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol
.
焙烧948t明矾(M=474g/mol),若SO
2的利用率为96%,可产生质量分数为98%的硫酸
②432
②432
t.




 名校课堂系列答案
名校课堂系列答案