
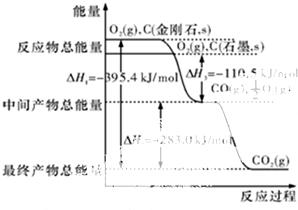
 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.分析 (1)只要能减少化石燃料等资源的运用都属于“开源节流”;
(2)(a)依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
(b)依据极值计算判断生成的气体组成,结合热化学方程式计算得到.
解答 解:(1)只要能减少化石燃料等资源的运用都属于“开源节流”;
b、大力开采煤、石油和天然气,不能减少化石燃料的运用,故错误;
a、c、d能减少化石燃料的运用,故正确.
故答案为:acd;
(2)(a)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1;
故答案为:石墨;393.5kJ?mol-1;
(b)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ•mol-1;C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ•mol-1,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1×0.5mol+110.5 kJ•mol-1×0.5mol=252kJ,即12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252kJ;
故答案为:252KJ.
点评 本题考查了化学反应与能量、物质稳定性的判断、键能的计算,题目难度中等,注意把握盖斯定律的含义及其应用方法.


科目:高中化学 来源: 题型:选择题
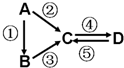 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
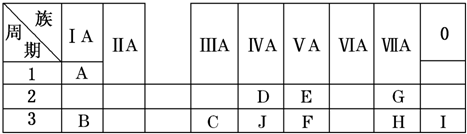
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com