
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA | |
| B. | 1.5 mol NO2与足量水反应,转移的电子数为1.5 NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
分析 A.氮气与氢气合成氨为可逆反应;
B.二氧化氮与水的反应为歧化反应;
C.6.4g混合物中含有6.4gS原子,含有0.2molS原子;
D.常温常压Vm≠22.4L/mol;
解答 解:A.合成氨为可逆反应,一定条件下,将1 mol N2和3 mol H2混合,不能完全反应生成2mol氨气,转移的电子数小于6NA,故A错误;
B.二氧化氮与水的反应为歧化反应,3mol二氧化氮转移2mol电子,故1.5mol二氧化氮转移1mol电子即NA个,故B错误;
C.6.4g由S2、S4、S8组成的混合物中含有6.4g硫原子,含硫原子的物质的量为:$\frac{6.4g}{32g/mol}$=0.2mol,含有的硫原子数为0.2NA,故C正确;
D.常温常压Vm≠22.4L/mol,无法计算氯气的物质的量,无法计算氯原子个数,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
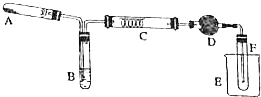 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com