
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
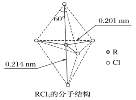
A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
【答案】C
【解析】
A.R原子最外层有5个电子,形成5个共用电子对;
B.根据键长越短,键能越大判断;
C.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°;
D.根据RCl5和RCl3的空间构型进行分析。
A.R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故A错误;
B.RCl5分子中5个R—Cl键,键长不都相同,键长不同,所以键能不完全相同,故B错误;
C.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故C正确;
D.由图可知RCl5分子空间构型是对称的,是非极性分子,而RCl3是三角锥形,是极性分子,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验(夹持仪器已省略)。
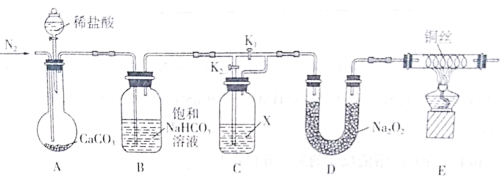
回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是________。
(2)饱和NaHCO3溶液的作用是_________;试剂X是___________。
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是_______。
(4)若_____(填操作),E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应。
(5)写出D中CO2与Na2O2反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 电子云表示电子在原子核外运动的轨迹
B. Fe3+的最外层电子排布式:3s23p63d5
C. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
![]()
A. N4分子的键角为109°28′B. N4的沸点比N2低
C. 1 mol N4分子所含共价键数为4NAD. N4分子中只含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
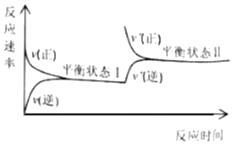
A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)和KNO3的溶解度随温度变化曲线如图所示:


下列分析错误的是( )
A.60℃时,AgBrO3,饱和溶液的浓度是0.596%
B.温度升高时AgBrO3,和KNO3溶解速度都加快
C.温度对AgBrO3,溶解度的影响比对KNO3溶解度的影响大
D.KNO3中少量AgBrO3可用重结晶的方法除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ:(1)将钠、铁、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:____________与盐酸反应最剧烈。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________。
Ⅱ:利用如图装置可验证同主族元素非金属性的变化规律。

(1)仪器B的名称为_____________,干燥管D的作用为防止______________________。
(2)若要证明非金属性:Cl>I-,则A中加浓盐酸,B中加KMnO4,KMnO4与浓盐酸常温下反应生成氯气,C中加淀粉-碘化钾混合溶液,观察到C中溶液__________________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(3)若要证明非金属性:![]() ,则在A中加盐酸、B中加
,则在A中加盐酸、B中加![]() 、C中加
、C中加![]() 溶液。观察到C中溶液_____________
溶液。观察到C中溶液_____________![]() 填现象
填现象![]() ,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶除去。
,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电化学装置”的结构如下图所示,下列说法正确的是( )
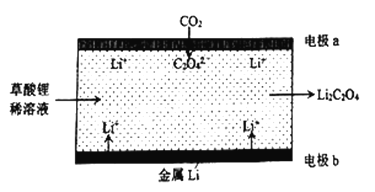
A. 该装置可由电能转变为化学能
B. 每生成20.4gLi2C2O4,有0.4molLi+从正极迁移至负极
C. 正极的电极反应为:C2O42--2e-=2CO2
D. 利用该技术可减少温室气体CO2的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com