
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g)![]() CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________。
(2)该可逆反应的正反应为_____________反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____(填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________(填“正向” “逆向”或“处于平衡状态”)。
【答案】 K = c(CO)·c(H2O)/c(CO2)·c(H2) 吸热 700℃ 增大 = 逆向
【解析】(1).因平衡常数等于生成物的平衡浓度幂之积除以反应物的平衡浓度幂之积,所以K=c(CO)c(H2O)/c(CO2)c(H2),故答案为:K= c(CO)c(H2O)/c(CO2)c(H2);
(2).化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热。
(3).根据K=c(CO)c(H2O)/c(CO2)c(H2)可知,当3c(CO2)·c(H2) = 5c(CO)·c(H2O)时,K=3/5=0.6,故该温度为700℃,所以答案是:700℃。
(4). ①在其他条件不变时,再向容器中充入2 mol CO2,根据平衡移动原理,此时平衡正向移动,H2的消耗量增大,转化率增大,故答案为:增大。
②根据表中数据可知,当温度为830℃时,化学平衡常数K为1.0,因平衡常数的大小只与温度有关,在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,因未改变温度,故平衡常数不变,K仍然为1.0,故答案为:=。
(5). 若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时该反应的浓度商Qc=(4 mol·L-1×4 mol·L-1)÷(2 mol·L-1×2 mol·L-1)=4,因1200℃时K=2.6,故Qc>K,则平衡逆向移动,故答案为:逆向。


科目:高中化学 来源: 题型:
【题目】下列关于溶液及配制的说法正确的是( )
A. 配制0.1mol·L-1CuSO4溶液450mL,需要CuSO4的质量是7.2g
B. 配制稀硫酸时,将量筒量取的浓硫酸倒入小烧杯中,加入少量水溶解
C. 配制一定物质的量浓度的溶液,若定容时俯视刻度线,导致所配溶液浓度偏高
D. 某温度下两种不同物质的溶液,若溶质的质量分数相同,则这两种溶液的物质的量浓度也一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新版元素周期表已全部填满,联合国2019年定为国际化学元素周期表年。鉨(Nh)是113号主族元素,其原子核外最外层电子数是3.下列说法不正确的是( )
A.Nh的金属性强于AlB.Nh是第七周期第IIIA族元素
C.Nh的原子半径小于同主族元素原子D.Nh在其化合态中主要呈+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液与20mL 1 molL—1 NaNO3溶液中NO3- 物质的量浓度相等的
A. 10 mL 1 molL-1 Mg(NO3)2溶液 B. 5 mL 1molL-1 Al(NO3)3溶液
C. 10 mL 0.5 molL-1 Ag NO3溶液 D. 10 mL 0.5molL-1 Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前不久,我国科学家合成了三种新核素,其中一种是 ![]() Hf.下列关于
Hf.下列关于 ![]() Hf的叙述中,正确的是( )
Hf的叙述中,正确的是( )
A.该元素的原子序数是72
B.该元素的原子序数是113
C.该核素的中子数为72
D.该元素的相对原子质量为了185
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
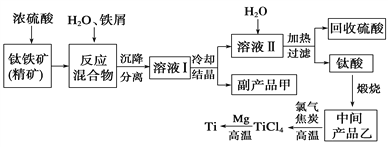
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com