
【题目】常温下,下列各组比值为1∶2的是( )
A.0.1mol·L-1与0.2mol·L-1 CH3COOH溶液,c(H+)之比
B.0.1mol·L-1 Na2CO3溶液,![]()
![]() c(Na+)之比
c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的H2SO4与CH3COOH溶液,![]()
![]() c(CH3COO-)之比
c(CH3COO-)之比
【答案】D
【解析】
A.醋酸是弱电解质,溶液中存在电离平衡,醋酸浓度越大其电离程度越小,所以0.1mol/L与0.2mol/L醋酸溶液,c(H+)之比大于1:2,故A错误;
B.0.1molL1Na2CO3溶液,CO32-离子水解浓度减小,![]() 与c(Na+)之比小于1:2,故B错误;
与c(Na+)之比小于1:2,故B错误;
C.Ba(OH)2为强电解质,完全电离,氨水为弱电解质溶液,部分电离,所以pH=10的Ba(OH)2溶液与氨水,c[Ba(OH)2]=![]() ×c(OH)=0.00005mol/L,c(氨水)>0.0001mol/L,溶质的物质的量浓度之比小于1:2,故C错误;
×c(OH)=0.00005mol/L,c(氨水)>0.0001mol/L,溶质的物质的量浓度之比小于1:2,故C错误;
D.pH=3的硫酸与醋酸溶液中氢离子浓度相等,根据电荷守恒得c(H+)=2c(SO42)=c(CH3COO),所以c(SO42)与c(CH3COO)之比等于1:2,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关.下列说法不正确的是![]()
A.医学上,血液透析是利用了胶体的渗析原理
B.碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂
C.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
D.铜的金属性比铝弱,可以用铜罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处可见金属和它们的化合物。
(1)金属钠与水反应后,向其中滴入石蕊试剂,溶液将呈_____色;
(2)已知一种生活中常见的金属,它既可以与盐酸反应也可以与氢氧化钠溶液反应,写出冶炼该金属的化学反应方程式:___________________________________;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,一段时间后,形成了较稳定的电流,则铝为该电池的_____(填电极名称);
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是_____(填化学式);
(5)鉴别三价铁离子和亚铁离子的方法有许多,其中之一就是利用加入酸性高锰酸钾溶液观察其是否褪色来进行判断,请写出该方法涉及的离子反应方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的硫酸钡放入水中,有关的叙述正确的是( )
A.硫酸钡不溶于水,硫酸钡固体质量不会改变
B.最终会得到BaSO4的极稀的饱和溶液
C.因为![]() 很容易发生,所以不存在BaSO4(s)
很容易发生,所以不存在BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的过程
Ba2+(aq)+SO42-(aq)的过程
D.因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
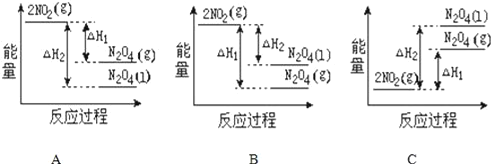
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
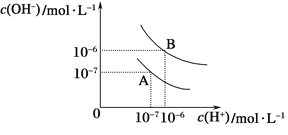
(1)则95℃时水的电离平衡曲线应为__(填“A”或“B”).
(2)25℃时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____
(3)95℃时,若1体积pH1=a 的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是:___(用含a、b的等式表示).
(4)95℃时,1L0.05mol/LBa(OH)2溶液中,由水电离出的c(OH-)为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质电离或盐类水解的离子方程式
(1)H2S _______________
(2)HClO _____________
(3)FeCl3 ______________
(4)Na3PO4 __________________
(5)泡沫灭火器的水解原理________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
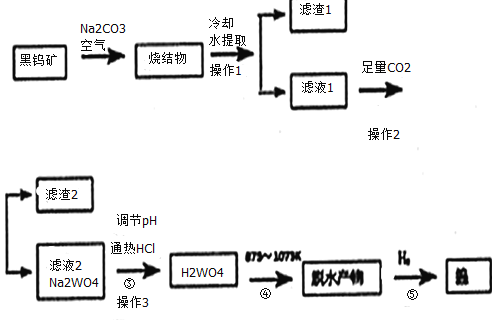
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com