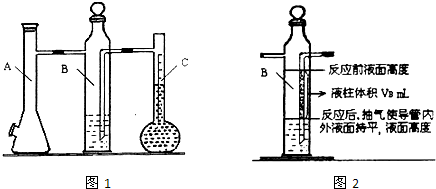
利用如图1所示实验装置可以测定一条条件下1mol气体的体积,图1中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H
2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H
2的体积.
实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
可以确认装置气密性合格.
(2)B中所装液体一般是
(填“水”或“品红”).A中发生反应的离子方程式为
.
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验次数 |
m(Mg)/g |
硫酸体积/mL |
液体量瓶中液体体积/mL |
抽出气体体积/mL |
氢气体积/mL |
计算1mol氢体积/L |
| 1 |
0.100 |
10.0 |
110.0 |
6.5 |
X |
|
| 2 |
0.115 |
10.0 |
121.0 |
8.0 |
|
|
①上表中X=
.
②计算1mol氢气体积两次实验的平均值=
L.
③计算实验误差:(实验值-理论值)/理论值×100%=
.
④引起该误关的可能原因
(填字母).
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分V
B)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是
(合理则填序号,否则填“无”).如有合理之处,请根据下面的数据给出修正的1mol氢气体积的数学表达式.(镁元素的相对原子质量为24.3)
| 实验次数 |
m(Mg)
g |
硫酸体积mL |
液体量瓶中液体体积mL |
抽出气体体积mL |
B瓶的一段液柱体积mL |
水汽体积百分含量 |
计算1mol氢体积L |
| 1 |
0.100 |
10.0 |
110.0 |
6.5 |
VB |
a% |
|
1mol氢气体积=
L(填写数学表达式).

 口算题天天练系列答案
口算题天天练系列答案