
【题目】下列各烃分别与H2完全加成,不能生成2,2,3-三甲基戊烷的是( )
A. 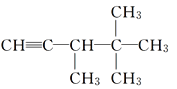 B.
B. 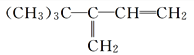 C. CH2-CHC(CH3)2CH(CH3)2D.
C. CH2-CHC(CH3)2CH(CH3)2D. 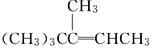
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498
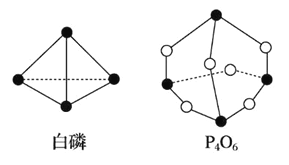
若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
A. 它的系统名称是2,4-二甲基-4-戊烯
B. 它的分子中至少有5个碳原子在同一平面上
C. 它与甲基环己烷(![]() )互为同分异构体
)互为同分异构体
D. 该有机物与氢气完全加成后的产物的一氯取代产物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物性质描述正确的是
A. 在Na2O2中阳离子与阴离子的个数比为2:1
B. 只有钠单质和钠盐的焰色反应呈现黄色
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. 氢氧化钠溶液具有碱性,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
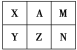
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与Li<Na<K<Rb<Cs的变化规律不符合的是( )
A.与水或酸反应置换氢气越来越剧烈B.金属性由弱到强
C.氧化性由弱到强D.原子半径由小到大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为
A. 0.08molB. 0.06molC. 0.11molD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向[H+]=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中[H+]=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A. 该温度高于25 ℃
B. 所得溶液中,由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 该温度下,此NaHSO4溶液与某pH=11的Ba(OH)2溶液混合后溶液呈中性,则消耗的NaHSO4溶液与Ba(OH)2溶液的体积比为100:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com