苯乙烯是重要的基础有机化工原料.工业中以乙苯(C
6H
5-CH
2CH
3)为原料,采用催化脱氢的方法制取苯乙烯(C
6H
5-CH=CH
2)的反应方程式为:C
6H
5-CH
2CH
3(g)?C
6H
5-CH=CH
2(g)+H
2(g)△H
1(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图1所示:600℃时,由图1可知:

①氢气的物质的量分数为
.
②乙苯的平衡转化率为
.
③计算此温度下该反应的平衡常数
.
(2)分析上述平衡体系组成与温度的关系图可知:
①△H
1
0(填“>”、“=”或“<”).
②当温度高于970℃,苯乙烯的产率不再增加,其原因可能是
.
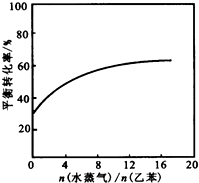
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,请在图2中画出.
乙苯的平衡转化率与
的关系曲线[
=12时,乙苯的平衡转化率基本保持不变].
(4)已知:3C
2H
2(g)?C
6H
6(g)△H
2C
6H
6(g)+C
2H
4(g)?C
6H
5-CH
2CH
3(g)△H
3则反应3C
2H
2(g)+C
2H
4(g)?C
6H
5-CH=CH
2(g)+H
2(g)的△H=
.


 ;
; ;
;

 寒假学与练系列答案
寒假学与练系列答案
 如图是氯化钠晶体的结构示意图,其中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构形为( )
如图是氯化钠晶体的结构示意图,其中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构形为( )

 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
