
【题目】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。

(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 molL-1的HNO3溶液,但是在实验室中只发现一瓶8 molL-1的HNO3溶液,该小组用8molL-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括________、_____mL量筒、烧杯、________、胶头滴管等。
②该实验中需要量取8molL-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取用8molL-1的HNO3溶液溶液时仰视量筒刻度线
B.量取用的量筒水洗后未进行任何操作
C.8molL-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
【答案】BaSO4 BaCO3 过滤 Na2CO3 HNO3 500mL 容量瓶 100 玻璃棒 62.5 AC
【解析】
由实验流程可知,加入过量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3。
(1)加入过量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反应生成BaSO4、BaCO3沉淀,故答案为:BaSO4; BaCO3;
(2)①②③中均进行的分离操作是分离固体和液体,为过滤操作,故答案为:过滤;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,故答案为:Na2CO3;HNO3;
(4)①实验室只有500mL的容量瓶,则本实验需要配制的溶液体积为500mL,另外需要用量筒量8mol/L的HNO3溶液倒在烧杯中加水溶解,同时需要玻璃棒搅拌,转移到容量瓶中时也需要玻璃棒引流,最后还需要用胶头滴管定容,整个实验需要的玻璃仪器包括500mL容量瓶、100mL量筒、烧杯、玻璃棒、胶头滴管等,故答案为:500mL 容量瓶;100; 玻璃棒;
②设需要量取8 molL-1的HNO3溶液VmL,则8 molL-1×V×10-3L=1 molL-1×500×10-3L,解得:V=62.5mL,故答案为: 62.5 ;
③A.取8molL-1的HNO3溶液时仰视刻度线,液面在刻度线上方,即浓硝酸的体积偏大,导致配制溶液浓度偏高,故A正确;
B.量取用的量筒水洗后未进行任何操作,会稀释浓硝酸,即浓硝酸的体积偏小,导致配制溶液浓度偏低,故B错误;
C.量筒量取浓硝酸后,不应该水洗,否则浓硝酸的体积偏大,导致配制溶液浓度偏高,故C正确;
D.定容时仰视刻度线,液面在刻度线上方,溶液体积偏大,导致浓度偏低,故D错误;
E.定容后,除容量瓶振荡摇匀,不能再加水定容,这样做对实验结果无影响,故E错误;故答案为AC。


科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是_____________;
(2)试剂A是______;
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是______;
a. 检验Cl2的存在 b. 检验Fe3+的存在 c. 检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是______(填字母)。
a b
b c
c d
d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
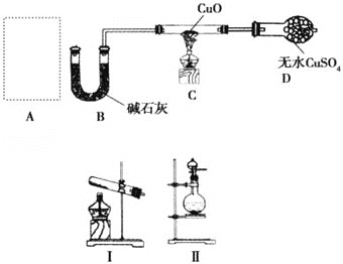
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Cu-Zn原电池示意图,下列叙述正确的是

A. 锌为负极,发生还原反应
B. 铜为负极,铜片上有气泡产生
C. 电子由铜片通过导线流向锌片
D. 溶液中的H+从铜片获得电子被还原成氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把7.8g镁铝合金的粉末放入过量的盐酸中,得到8.96 LH2(标准状况下)。该合金溶于足量NaOH溶液,产生H2的体积(标准状况下)为____________ 。
(2)相同条件下,某Cl2与O2混合气体75mL恰好与100mL H2化合生成HCl和H2O,则混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是2:5,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是()
A.0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ·mol﹣1,则H2的燃烧热为571.6kJ·mol﹣1
D.CO(g)的燃烧热是283.0kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.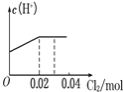 B.
B.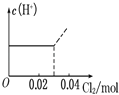
C.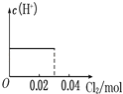 D.
D.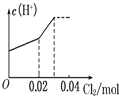
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com