

| CuO |
| CeO2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 160℃ |
| ||
| 160℃ |
| ||
| ||
| 1 |
| 4 |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、植物油的不饱和程度高于动物油,植物油更易氧化变质 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 |
| C、过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:1 |
| D、向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液不一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少? | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
C、溶液中
| ||
| D、再加入10 mL pH=ll的NaOH溶液,混合液的PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
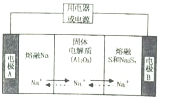 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O和Na2O2组成元素相同,化学性质也完全相同 |
| B、向硫酸铝溶液中逐滴加人过量氢氧化钡溶液,会出现先沉淀后完全溶解的现象 |
| C、等物质的量浓度的NH4Cl和CH3COONH4溶液中的c( NH4+)相等 |
| D、高纯度二氧化硅广泛用于制光导线维,光导纤维遇强碱时会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的电化学腐蚀 |
| D、外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、R可能是气态物质,也可能是固态物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com