
【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
(5)下列图像符合反应①的是________________________。
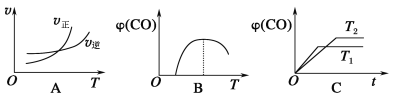
【答案】50% 1.50 < B A
【解析】
根据勒夏特列原理判断温度升高时,反应平衡常数变化与反应热的对应关系,并基于反应热分析使平衡正向移动的条件,据此回答问题。
(1)若500 ℃时进行反应①,反应平衡常数K=![]() ,即反应生成的一氧化碳的浓度等于反应剩余的二氧化碳的浓度,根据气体反应系数比为1:1可知,CO2的转化率为50%。
,即反应生成的一氧化碳的浓度等于反应剩余的二氧化碳的浓度,根据气体反应系数比为1:1可知,CO2的转化率为50%。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=
H2O(g)+CO(g),其平衡常数K3=![]() 。
。
(3)根据表格可知,温度升高,反应平衡常数减小,反应逆向移动,正反应为放热反应,故反应②的焓变ΔH< 0。
(4)700 ℃时反应②达到化学平衡,该反应正反应放热,且反应前后气体体积不变,故要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施为B。
A.缩小容器容积,不改变平衡状态,A错误;
B.加入更多的水蒸气 ,增大反应物,平衡正向移动,B正确;
C.升高温度至900 ℃,根据勒夏特列原理,反应逆向移动,C错误;
D.使用合适的催化剂,不改变反应平衡,D错误。
答案为B。
(5)反应①温度升高,平衡常数增大,反应正向移动,正反应为吸热反应,且反应前后气体体积不变,故:
A. 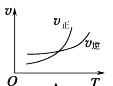 温度升高,正反应速率大于逆反应速率,反应正向移动,符合反应①;
温度升高,正反应速率大于逆反应速率,反应正向移动,符合反应①;
B. 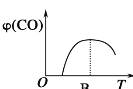 在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图像表示正反应为放热反应,不符合反应①;
在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图像表示正反应为放热反应,不符合反应①;
C.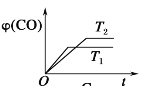 到达平衡的时间越短,速率越快,温度越高,说明T1温度高于T2,但T1的一氧化碳含量低于T2,平衡向逆反应方向移动,说明反应正方向放热,不符合反应①。
到达平衡的时间越短,速率越快,温度越高,说明T1温度高于T2,但T1的一氧化碳含量低于T2,平衡向逆反应方向移动,说明反应正方向放热,不符合反应①。
答案为A。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),结构如图所示。人体缺乏维生素C易得坏血症,所以维生素C又称抗坏血酸。下列关于维生素C的叙述正确的是
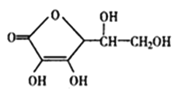
A.维生素C化学式为C6H7O6
B.维生素C能与溴水或酸性高锰酸钾发生加成反应而使其褪色
C.维生素C分子中含有羧基
D.维生素C可发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾(K)资源丰富,成本低廉,用其制作的钾离子电池有着超越锂离子电池的发展前景。我国科研人员在钾离子电池的研发上做出了巨大的贡献。如图是我国某科研团队研制的一种钾离子电池充电时的示意图,下列说法不正确的是( )
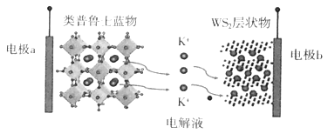
A.放电时,外电路电子由电极a流向电极b
B.钾离子电池电解液一般选择有机溶剂,但会有一定的安全隐患
C.充电时,每当外电路中转移1mole-,正极材料会“释放”39gK+
D.充电时,电极b上的电极反应式为:WS2+xK++xe-=KxWS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____,反应进行程度最大的是_____。
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________(填化学式)。

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
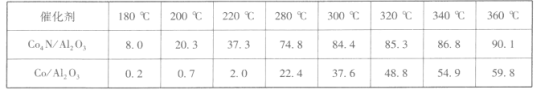
分析上表数据可知:_____(填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
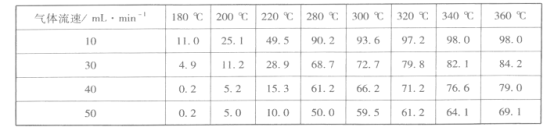
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____(填“增大”或“减小”),其可能的原因是_________________________________。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________。(已知Co的性质与Fe相似)
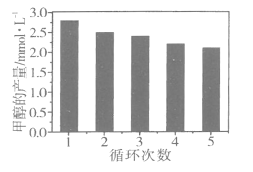
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空
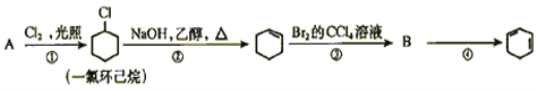
(1)A的名称是__________B的结构简式是_________
(2)②的反应类型是__________。③的反应类型是__________。
(3)反应④的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→ 2CO2+3H2O,电池示意如右图,下列说法正确的是
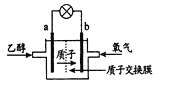
A. a极为电池的正极
B. b极发生氧化反应
C. 负极的反应为:4H++O2+4e-===2H2O
D. 电池工作时,1mol乙醇被氧化时有12mol转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
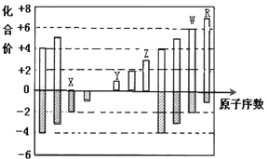
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. C 的体积分数降低 D. B的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH溶液捕获CO2。向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.
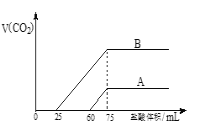
(1)曲线B表明原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_____________,其物质的量之比为__________________。当耗盐酸0<v(HCl)<25 mL时发生的离子反应为:____________。
(2)曲线A表明,最初通入的CO2在标准状况下的体积为_________mL。
(3)通过计算求出原NaOH溶液的物质的量浓度______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com