
| A、甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol |
| B、光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、聚乙烯、蛋白质和纤维素都是天然高分子化合物 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、该电池的正极为锂 |
| B、该电池充电时Li+阳极移动 |
| C、电池正极反应式为:FePO4+Li++e-═LiFePO4 |
| D、当0.1mol LiFePO4生成时,流经电解质的电子个数为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
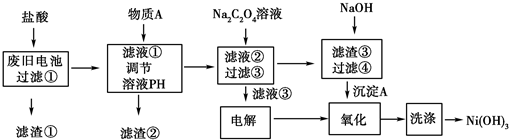
| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使石蕊试液变红的溶液中:I-、MnO4-、NO3-、Na+ |
| B、含有大量Fe3+的溶液:NH4+、HCO3-、SO42-、AlO2- |
| C、水电离出C(H+)=1.0×10-12mol/L 的溶液:Cl-、Na+、ClO-、NH4+ |
| D、澄清透明的溶液:Cu2+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS在水中的电离方程式为:NaHS=Na++HS-和HS-=H++S2- |
| B、同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3?H2O)<V(HCl) |
| C、Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D、同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,体系的颜色变浅 |
| B、保持温度和容器体积不变,再充入1moLNO2气体,当达到新平衡时NO2的体积分数将增大 |
| C、保持温度和容器体积不变,再充入0.5moLN2O4气体,当达到新平衡时N2O4的体积分数将增大 |
| D、若保持温度不变,压缩容器的体积,达到新平衡时混合气体的颜色变浅,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| C、0.012kg(金刚石)中含有c-c键数目为2NA |
| D、常温常压下,1.7g H2O2中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、360mg |
| B、3.6g |
| C、0.36g |
| D、2.5×10-4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com