
| A、Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| B、Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜 |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| D、加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl- |


科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | L层上有2对未成对电子 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、没有洗涤烧杯和玻璃棒 |
| B、定容时凹液面最低点低于刻度线 |
| C、容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液 |
| D、转移过程中有少量溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
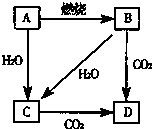 如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:
如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C、“绿色化学”的核心是利用化学原理进行环境治理 |
| D、生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
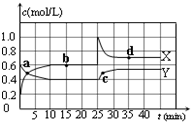 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com