
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 生物柴油是不同酯组成的混合物 | |
| C. | 乙酸乙酯和乙醇的混合物可以用分液的方法进行分离 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
分析 A.碘为人体的微量元素,不能过量摄入;
B.生物柴油可由地沟油等制备;
C.乙酸乙酯和乙醇混溶;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气.
解答 解:A.碘是人体必需微量元素,所以要吃富含KIO3的食盐,但不能多吃,多吃会导致升高血压,促进动脉粥样硬化,故A错误;
B.生物柴油可由地沟油等制备,为酯类物质,故B正确;
C.乙酸乙酯和乙醇混溶,溶液不分层,不能用分液的方法分离,故C错误;
D.工业应用电解熔融的氯化钠制备钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,故D错误.
故选B.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能够使溴水褪色,是因为乙烯和溴水反应生成了2-溴乙烷 | |
| B. | 将红热的铜丝插入到1-丙醇中,可以制得丙酮 | |
| C. | 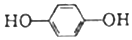 和苯酚互为同系物 和苯酚互为同系物 | |
| D. | 分子式为C10H12具有两个邻位链烃取代基的芳香烃有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
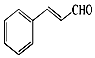 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )| A. | 肉桂醛分子中含有两种官能团,分子式为C9H8O | |
| B. | 肉桂醛分子中最多有18个原子共平面 | |
| C. | 1 mol肉桂醛与氢气加成时最多消耗4 mol H2 | |
| D. | 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 | |
| C. | 图3所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| D. | 图4所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液 | |
| C. | 用水润湿pH试纸测量某溶液的PH | |
| D. | 实验室用NaOH溶液除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等 | |
| B. | 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50% | |
| C. | 金属钠着火时,立即用泡沫灭火器灭火 | |
| D. | 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
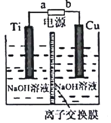
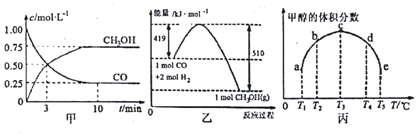
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com