
分析 (1)碳酸钠与盐酸反应生成氯化钠和二氧化碳和水;
(2)依据碳酸氢钠不稳定受热分解解答;
(3)铝能够与氢氧化钠溶液反应,镁不反应;
(4)氯化铁能够与铁反应生成氯化铁.
解答 解:(1)除去混入NaCl溶液中少量Na2CO3杂质的试剂是盐酸,碳酸钠与盐酸反应生成氯化钠和二氧化碳和水,离子方程式:盐酸;2H++CO32-=H2O+CO2↑,
故答案为:盐酸;2H++CO32-=H2O+CO2↑;
(2)除去Na2CO3粉末中混入的NaHCO3杂质用加热方法,因为碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳,化学方程式:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2;
故答案为;加热; 2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2;
(3)除去铁粉中混有铝粉的试剂是NaOH溶液,因为铝能够与氢氧化钠溶液反应,离子方程式:2Al+2OH-+2H2O=2AlO2-+H2↑;
故答案为:氢氧化钠溶液;2Al+2OH-+2H2O=2AlO2-+H2↑;
(4)氯化铁能够与铁反应生成氯化铁,除去FeCl2溶液中混有FeCl3的试剂是铁粉,反应的离子方程式:2Fe3++Fe=3Fe2+;
故答案为:铁粉;2Fe3++Fe=3Fe2+.
点评 本题考查了物质的分离提纯,侧重考查离子方程式的书写,明确除杂的原子及离子反应的实质是解题关键,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
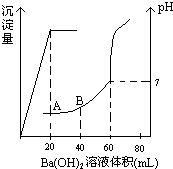 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Ca(OH)2和CO2 | C. | NaOH和HCl | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
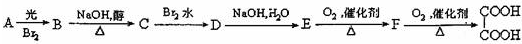
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
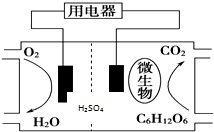
| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com