
| A. | 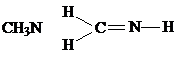 | B. | 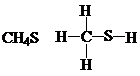 | ||
| C. |  | D. | 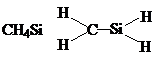 |
分析 根据每种元素形成的化学键判断正误,氮原子能形成3个共价键,碳原子能形成4个共价键,硫原子能形成2个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键.
解答 解:A.该分子中每个氢原子能形成1个共价键,氮原子能形成3个共价键,碳原子能形成4个共价键,成键合理,故A不选;
B.该分子中碳原子能形成4个共价键,硫原子能形成2个共价键,氢原子能形成1个共价键,成键情况合理,故B不选;
C.该分子中每个碳原子能形成4个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键,硫原子能形成2个共价键,从而使各个原子能达到稳定结构,故C不选;
D.C、Si原子能形成4个共价键,成键情况不合理,故D选;
故选:D.
点评 本题考查了化学键的判断,明确每个原子价层电子数是解本题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
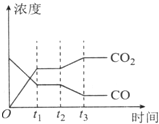 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(02)/mol•L-1 | c(C02)/mol•L-1 | V(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | V(正)=v(逆 |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | V(正)> v(逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
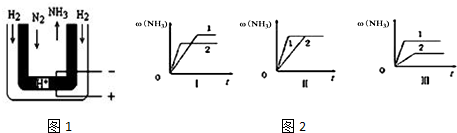
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
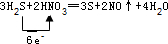 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com