


科目:高中化学 来源: 题型:
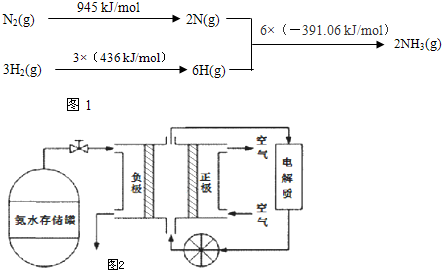
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应为吸热反应 |
| B、正反应为放热反应 |
| C、CO的浓度增大 |
| D、各物质的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将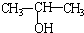 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸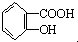 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备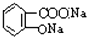 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正.逆反应速率同时增大,平衡不移动 |
| B、正.逆反应速率同时增大,NH3百分含量增大 |
| C、正反应速率增大,逆反应速率减小,平衡向逆反应移动 |
| D、正.逆反应速率不变,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、Cl-、Na+、H+ |
| B、Al3+、K+、OH-、SO42- |
| C、Fe2+、NO3-、SO42-、H+ |
| D、K+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中存在Fe3+和Fe2+ |
| B、1.12L气体是NO、NO2的混合气体 |
| C、反应后溶液中c(NO3-)=0.85mol?L-1 |
| D、反应后的溶液最多还能溶解1.4gFe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com