
分析 (1)依据m=nM,N=nNA结合氢氧化钡、硫酸结构解答;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合氧气、臭氧的结构解答;
(3)依据水分子的结构,n=$\frac{m}{M}$解答;
(4)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合二氧化硫、三氧化硫分子结构解答;
(5)1mol硫酸铝中含有2mol铝离子、3mol硫酸根离子;
(6)依据n=$\frac{m}{M}$=$\frac{V}{Vm}$计算;
(7)同温同压下,同体积的气体物质的量相同,气体的质量之比等于相对分子质量之比;根据质量计算物质的量,气体的体积之比等于物质的量之比;根据物质的量和分子的组成判断氢原子数目之比;根据分子组成计算氢原子数相等时物质的量关系,进而计算体积之比;
(8)①依据n=CV=$\frac{m}{M}$计算解答;
②溶液具有均一性,结合n=CV=$\frac{m}{M}$计算解答.
解答 解:(1)1mol氢氧化钡含有1mol钡离子和2mol氢氧根离子,个数为2NA;2mol H2SO4的质量:98g/mol×2=192g,故答案为:1;2NA;192;
(2)依据n=$\frac{N}{N{\;}_{A}}$可知分子个数与物质的量成正比,相同物质的量的O2和O3,所含分子的数目之比:1:1;所含O的物质的量之比:1×2:1×3=2:3;
故答案为:2:3;
(3)1个水分子含有2个H、1个O,3个原子,10个电子,18g水物质的量为$\frac{18g}{18g/mol}$=1mol,含2mol H,含1mol O,含原子共3mol,含电子共10mol;
故答案为:1;2;1;3;10;
(4)设与19.2g SO2所含氧原子数目相同的SO3的物质的量为x,则:$\frac{19.2g}{64g/mol}$×2=n×3,解答n=0.2mol;
故答案为:0.2;
(5)含有0.4mol Al3+的Al2(SO4)3溶液中硫酸铝的物质的量为0.2mol,所含SO42-的物质的量是0.2mol×3=0.6mol;
故答案为:0.6;
(6)在标准状况下,4g O2 体积为$\frac{4g}{32g/mol}$×22.4L/mol=2.8L;
故答案为:2.8;
(7)根据阿伏加德罗定律定律,相同条件下,相同体积的任何气体都含有相同的数目的粒子,
则同温同压下,同体积的气体物质的量相同,根据m=n•M可知,
气体的质量之比等于相对分子质量之比,所以同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为17:34=1:2;
设氨和硫化氢气体的质量分别为34g,则n(NH3)=$\frac{34g}{17g/mol}$=2mol,n(H2S)=$\frac{34g}{34g/mol}$=1mol,
相同条件下,物质的越多,气体的体积越大,则同质量的氨和硫化氢气体的体积比为2:1;
2molNH3中H原子的个数为:2mol×3×NA/mol=6NA,
1molH2S中H原子的个数为:1mol×2×NA/mol=2NA,
其中含有的氢的原子个数比为:6:2=3:1;
若二者氢原子数相等,设含有6molH原子,则
氨气的物质的量为2mol,硫化氢的物质的量为3mol,
则体积之比为2:3.
故答案为:1:2;2:1;3:1;2:3;
(8)①用14.2Na2SO4配置成500mL溶液,其物质的量浓度为:$\frac{\frac{14.2g}{142g/mol}}{0.5L}$=0.2mol/L;
故答案为:0.2;
②溶液具有均一性,浓度与体积无关,所以若从中取出50mL溶液,其物质的量浓度为0.2mol/L,含有溶质的物质的量为:0.2mol/L×0.05L=0.01mol,质量为0.01mol×142g/mol=1.42g;
故答案为:0.2;1.42.
点评 本题考查物质的量的有关计算以及阿伏加德罗定律及推论的应用,题目难度不大,注意物质的量与质量、体积、微粒数目之间的计算公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | 0.16mol | B. | 0.21mol | C. | 0.30mol | D. | 0.48mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,冷凝管中冷却水应低进高出 | |
| B. | 萃取操作时,必须选择密度比水大的萃取剂 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
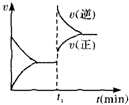
| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | B. | 2SO2(g)+O2(g)?2SO3(g)△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g)△H>0 | D. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
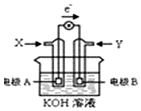
| A. | X位氧气 | |
| B. | 电极材料活泼性为:A>B | |
| C. | 电极B附近溶液碱性增强 | |
| D. | 电极A的反应式:CH3OH-6e-+H2O═CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:Na+、K+、MnO4-、S2O32- | |
| B. | 和Al反应能产生氢气的溶液:K+、NH4+、Cl-、S2- | |
| C. | 中性溶液:Al3+、K+、SO42-、AlO2- | |
| D. | c(H+)<c(OH-)的溶液:Na+、K+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应中为了提高正反应速率,及时抽走氨气 | |
| B. | SO2催化氧化中通入过量空气可提高SO2的平衡转化率 | |
| C. | 合成氨中加入催化剂可提高氮气的平衡转化率 | |
| D. | 合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com